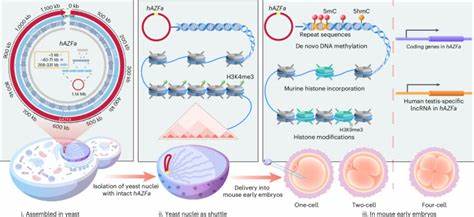
近年来,基因合成与组装技术取得了飞速发展,合成微生物基因组与人工染色体的成功构建推动了基因组写作进入崭新阶段。然而,将这种技术扩展至哺乳动物,特别是合成整条染色体级别的人类DNA序列,依然面临巨大挑战。近日,一项开创性的研究通过全新方法,成功实现了对百万碱基规模人类DNA序列的化学合成、酵母中的精准组装,以及将其完整、安全地递送进小鼠早期胚胎中。这一科研突破不仅提供了研究复杂基因组调控的新平台,也为人类疾病模型构建和合成生物学应用奠定了坚实基础。该项研究由天津大学等机构科学家领衔完成,成果发表在《自然方法》杂志,成为基因合成领域具有里程碑意义的进展。核心技术SynNICE的创新运用,解锁了大型人类DNA分子的设计合成与胚胎递送难题,为深入探究哺乳动物基因调控及表观遗传机制提供强大工具。
该研究以人类Y染色体的AZFa区域作为合成模板,构建约1.14 Mb的连续DNA序列并引入多个水印序列,确保后续追踪及序列鉴定。AZFa区域含丰富重复序列,占比达近七成,且与人类生殖相关的关键基因紧密关联。选择AZFa不仅因其与重度男性不育症相关,且在小鼠无同源位点可减少外源干扰,为跨物种基因调控研究提供理想模型。为了应对巨型、重复序列合成的难题,研究团队设计了分层组合组装策略。初步将化学合成的233个短片段(约5.5 kb)分批组装成23个中等长度片段,进而利用酵母两性细胞交配配合CRISPR介导的序列特异裂解,高效地拼接成四个大型片段,最终合成完整染色体级1.14 Mb合成DNA片段。酵母作为合成和存储载体,不仅具有高效的同源重组能力,还能在其天然染色质环境中维持合成DNA的稳定表达,最大限度减少序列丢失和重排。
科学家们详细验证了合成DNA在酵母中的稳定性及表观状态,发现在转录组以及蛋白质组层面未见显著异常变化,同时Hi-C染色质捕获技术揭示合成DNA拥有独特的三维结构,证明大型人类DNA可以在远缘物种的细胞环境内形成稳定染色质构象。面对传统基因片段提取易碎且带有细菌甲基化等缺陷,团队开创了NICE(Nucleus Isolation for Chromosomes Extraction)技术,巧妙通过酵母细胞破壁、缓冲条件优化及酶抑制,获得高纯度完整的含合成DNA的酵母细胞核。该技术保护了巨型DNA链不被降解和破损,有效保持染色质结构,为后续体内递送提供保障。将隔离完好的酵母细胞核微注射进小鼠成熟卵母细胞的细胞质中,实现跨物种的DNA传递,开辟了大型合成DNA跨界应用新模式。注射后,科学家使用荧光标记追踪,发现鼠源组蛋白H3.3和H2B可迅速替代酵母组蛋白,完成核内染色质重塑,体现出哺乳动物细胞对外源DNA的天然适应与整合能力。这一过程发生在单细胞初期,表明重组分子的即时整合为研究后续基因表达制导奠定基础。
鉴于酵母原生DNA缺乏甲基化修饰,研究特别关注合成DNA甲基化的建立过程。实验发现,在注射后的早期胚胎中,合成人类DNA实现了脱零开始的去新建立甲基化,且甲基化水平在单细胞阶段达到约46%。有趣的是,大部分的DNA甲基化集中于重复序列和非编码区,远超过其在整个人类AZFa区域的比例。这一发现揭示了DNA序列依赖性的甲基化机制,并提示表观遗传沉默对调节大型基因组区域结构及稳定性的重要性。同时,研究利用随机序列合成的244 kb人工DNA作为对照,甲基化水平极低,确认甲基化非随机发生,需特定序列元素驱动。继DNA甲基化建立,基因表达调控开展。
RNA测序结果显示,AZFa区域的关键基因如DDX3Y、UTY及特异性lncRNA TTTY15,在四细胞期起始表达。表达时序与人类胚胎天然基因表达类似,但更贴合小鼠同源基因的调控节律。药物干预实验证实,DNA甲基转移酶抑制剂促进早期基因表达启动,TET酶抑制剂逆转甲基化重编程,抑制基因激活,进一步确证甲基化动态调控表达的核心作用。该创新研究不仅在合成大型哺乳动物DNA保护与递送技术上取得突破,更首次在早期胚胎中动态揭示合成人类DNA表观遗传修饰和转录调控过程。SynNICE方法突破了传统技术在DNA大小和递送效率上的限制,实现了对极大规模、复杂重复序列DNA的精确合成与功能验证。通过将大型合成DNA嵌入小鼠胚胎进行原生环境中的调研,开辟了从基础机制到临床应用的广泛前景。
该平台未来可用于系统改造人类疾病相关基因组区域,探索基因与表观遗传互作规律,加快基因组工程与精准医学发展。此外,采用细胞核作为递送载体的概念,为今后实现单一或多段合成人工染色体的联合递送提供了可行性,有望构建更复杂的合成基因组体系。尽管该系统目前尚未实现合成DNA在胚胎中的稳定复制,但其稳定传递至囊胚期已充分展现出实现多代遗传的潜力。后续利用人工染色体向导技术结合该方法,或将实现合成染色体的完整功能验证和遗传稳定性。该研究突破了基因合成技术应用哺乳动物胚胎的关键技术瓶颈,也丰富了我们对基因组初始建构和发育过程的理解。合成基因组科学正在迈向整体哺乳动物基因组改造时代,SynNICE的成功意义深远。
总体来看,该成果是基因合成、表观遗传学与发育生物学交流融合的范例,将推进合成生物学在生命科学与生物医药领域的革命性应用。未来,随着技术优化和多学科合作,合成巨型DNA载体和精准递送方案,有望为疾病模型创建、药物筛选、基因治疗及人类基因组重构提供关键支持,开创循环升级的精准生命工程新时代。合成基因组时代的大门正逐渐开启,科学家们正以创新锐意开拓未来生命科技的新蓝海。