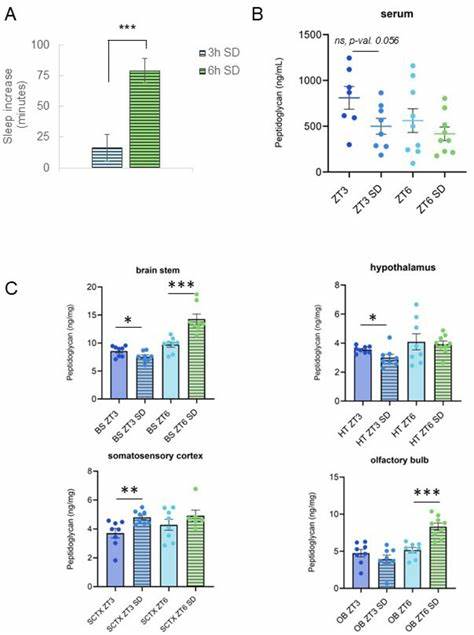
随着科学技术的发展,神经科学与微生物研究的交集日益明晰,人体与微生物的共生关系正深刻影响着对睡眠机制的理解。肽聚糖作为细菌细胞壁的重要组成部分,早在上世纪八十年代便被发现具有诱导睡眠的作用。近年来,研究者们进一步发现,细菌肽聚糖在大脑中的含量并非恒定,而是随着昼夜节律和睡眠状态的变化而出现明显波动,表现出脑区特异性及时间依赖性,引发了对其在睡眠调节中作用的新一轮关注。细菌肽聚糖不仅是微生物细胞壁的关键结构分子,其相关的免疫调节功能使其成为连接肠道微生物群与大脑神经活动的桥梁。活跃的微生物群通过肽聚糖及其衍生小片段进入宿主循环系统,并最终影响中枢神经系统,介导睡眠相关神经炎症因子的表达与调控。新研究显示,肽聚糖在脑干、嗅球、下丘脑及躯体感觉皮层等与睡眠调控密切相关的脑区呈现不同含量及动态变化,最高水平通常出现在脑干。
肽聚糖含量的波动与动物的休息与活动周期高度吻合,尤其是在转换醒睡状态的时间点表现为最低含量,这种时序性为进一步理解睡眠生理学提供了重要线索。睡眠剥夺实验揭示,睡眠不足会引发脑内肽聚糖水平的显著变化,且这种变化脑区依赖性强。例如,短时间睡眠剥夺期间,躯体感觉皮层的肽聚糖水平上升,而脑干及下丘脑则出现下降;而延长的睡眠剥夺则导致脑干和嗅球肽聚糖含量显著增加。这种不一致的变化可能反映了不同脑区对肽聚糖的摄取、代谢或清除机制的差异。此外,肽聚糖的信号识别通路也受到睡眠剥夺的调控。在睡眠剥夺的条件下,脑中包括PGLYRP1(肽聚糖识别蛋白1)在内的多种相关基因表达发生变化,显示出免疫及炎症信号网络的活跃调节,进一步推动了像白细胞介素1(IL-1)和肿瘤坏死因子α(TNFα)等促睡眠炎症因子的调节作用。
这些发现印证了肽聚糖不仅作为外源性免疫刺激物,还可能作为昼夜节律中的内源性信号分子参与调节睡眠的复杂网络。微生物-宿主相互作用中的节律性特征进一步被发现,肠道微生物的基因表达和代谢活动受到昼夜周期的影响,定时释放肽聚糖分子进入循环系统。肽聚糖经血脑屏障转运进入脑组织的机制仍在探索中,相关研究提示血脑屏障的通透性及脑内清除机制同样存在昼夜波动,且睡眠状态对血脑屏障的完整性有直接影响,这或许解释了脑内肽聚糖含量随时间及睡眠状态波动的现象。尽管目前尚不完全清楚肽聚糖的具体来源路径,肠道微生物群无疑是其重要的储存库与启动站。睡眠剥夺对肠道屏障完整性的破坏及相关菌群组成的改变,可能加剧肽聚糖的转运及脑内积累,从而影响脑免疫微环境与睡眠调节网络。值得强调的是,肽聚糖的作用并非单一方向,其不同脑区的波动表现反映了多层次的调控复杂性,如脑干肽聚糖水平的升降与整体睡眠驱动力的调节存在高度关联,同时皮层区域的波动则紧密影响睡眠恢复过程及认知功能。
睡眠剥夺相关基因表达谱显示,多条细胞信号通路及免疫反应路径参与了这一动态调节,标志着肽聚糖作为信号分子参与了睡眠-免疫轴的重要环节。最新的RNA测序分析也证实,多种肽聚糖识别受体及信号适配蛋白的表达随睡眠剥夺而显著变化,提示肽聚糖在调节睡眠需求、促进睡眠恢复及维持脑内免疫稳定中扮演着不可或缺的角色。日益丰富的证据表明,睡眠调节机制不仅限于神经元电活动及经典神经化学信号,更包含了免疫介质与微生物衍生分子的复杂交互。肽聚糖的动态变化及其受睡眠状态调节的特性,为传统睡眠生理学注入了微生态学视角,揭示出宿主与微生物共生体系如何通过分子水平的互通影响睡眠质量与脑功能。未来的研究需要进一步解密肽聚糖来源、其在不同脑区渗透与降解机制,以及其如何与经典的睡眠调节通路相互作用。此外,探索肽聚糖在神经精神疾病、睡眠障碍以及免疫功能异常中的作用,将对医学干预提供新思路。
综合现有研究,肽聚糖及其受体系统成为神经免疫网络中的关键节点,介导睡眠需求信号的生成与传递,同时与机体昼夜节律紧密耦合,确保睡眠-觉醒周期的生理稳态。整体来看,细菌肽聚糖作为微生物与脑部神经免疫桥梁的角色日益突显,其脑区特异性、时间依赖性及对睡眠剥夺的敏感性为理解神经系统与微生物生态的相互作用提供了重要视角。关注这一领域,将为揭开睡眠调节的奥秘带来革命性突破,有望推动睡眠医学、神经免疫学及微生态学的深度融合,为促进公众健康和相关疾病治疗提供科学基础和策略指导。 。