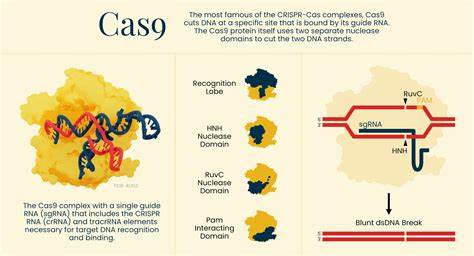
近年来,基因组编辑技术以其精准、高效的特点迅速崛起,成为生命科学领域的热门话题。尤其是CRISPR技术的出现,彻底改变了人类改写基因密码的方式。从最初微生物天然免疫系统中的防御机制,到如今广泛运用于医学、农业和环境保护的多样化工具,基因组编辑技术展现了令人瞩目的潜力和发展空间。本文将深入探讨当前主要的基因组编辑系统,揭示它们的工作原理、技术优势及临床应用前景。 在2012年,科学家Jennifer Doudna和Emmanuelle Charpentier成功将Cas9蛋白重新编程,以指导RNA实现对特定DNA序列的精准切割。这一突破打破了传统基因编辑工具的局限,使得基因组编辑进入了便捷、高效的新纪元。
Cas9蛋白源自链球菌,通过结合向导RNA识别特定DNA序列,识别靶点旁边的短序列PAM后进行双链断裂。修复过程中,细胞可通过非同源末端连接或者同源定向修复机制进行DNA的修复和改造,赋予科学家操控基因的可能。随后,Feng Zhang团队在人体细胞中成功实现Cas9功能,推动基因编辑技术向临床转化迈出了重要一步。Cas9的广泛性和高效率,使其至今依然是基因编辑领域最受欢迎的工具。 然而,尽管Cas9功能强大,但其脱靶效应难以完全避免,即非预期的基因序列也被切割,带来潜在安全隐患。为解决这一问题,科研人员持续优化Cas9蛋白结构及向导RNA设计,提升特异性,减少副作用。
另外,天然存在的Cas9变种,如来源于脑膜炎奈瑟菌的NmeCas9,表现出了更高的精确性,而来自热嗜菌Geobacillus的GeoCas9则能在更高温度下稳定发挥作用,丰富了编辑工具的适用范围。同时体积更小的Cas9变异体也为基因编辑的体内递送提供了便利,为临床应用铺平道路。 除了Cas9,Cas12家族基因编辑蛋白的发现同样令人瞩目。2015年,Feng Zhang团队揭示了Cas12a(原稱Cpf1)蛋白,其与Cas9相比拥有较为独特的机制:仅需一条crRNA即可形成活性复合物,识别PAM序列,随后利用单一的RuvC域切割双链DNA,产生末端粘性突出,促进精确的DNA修复。Cas12蛋白对目标序列的容忍度较低,提高了编辑的特异性能。更重要的是,Cas12具有强大的“副切割”活性,结合目标DNA后能够切割周围单链DNA,这一特性被巧妙应用于核酸检测领域,例如COVID-19病毒检测,使得分子诊断技术的灵敏度大幅提升。
尽管Cas12尚无FDA批准的临床治疗产品,但目前已有多项针对血液疾病的临床试验正在推进中,展现了广阔的应用前景。 不同于Cas9和Cas12主要靶向DNA,Cas13家族则专司切割RNA,作为新兴的RNA编辑工具引起关注。Cas13依赖于仅含crRNA的复合物,识别并结合特定的RNA序列后,通过HEPN结构域切割单链RNA。Cas13也存在与Cas12类似的“旁切”效应,导致切割附近非目标RNA。最初在人体细胞中观察到Cas13相对较低的脱靶,但后续研究发现其可能引发细胞毒性,目前具体机制尚未完全厘清。借助脱活化Cas13,科学家还成功开发了RNA表达调控工具和RNA碱基编辑系统,实现对RNA序列的精准改写或表达阻断。
这些技术被用于治疗如年龄相关黄斑变性等与RNA调节相关的疾病,并于2024年进入临床试验阶段,标志着RNA编辑治疗的崭新里程碑。 基于Cas9系统的基础上,科学家们还研制出了无须双链断裂即可对单个碱基进行精准修饰的基础编辑器。基础编辑技术通过将Cas9核酸酶活性减弱的“切裂酶”与脱氨酶融合,能够实现C→T和A→G的碱基转换,避免双链断裂导致的非预期变异。作为更安全和高效的替代方案,基础编辑现已广泛应用于遗传疾病的基因修复。Verve Therapeutics于2022年启动了首个基于基础编辑的临床试验,针对控制胆固醇的PCSK9基因变异进行治疗。Beam Therapeutics专注于镰状细胞贫血症的基础编辑疗法,GenAssist Therapeutics则在2024年推进了杜氏肌营养不良症治疗相关的基础编辑临床试验。
2025年,基础编辑技术更首次实现了个性化治疗,成功逆转罕见代谢病卡巴莫酰磷酸合成酶1缺乏症,彰显其在精准医疗上的巨大潜力。 2019年,David Liu团队首次报道了质子编辑器,它将Cas9切裂酶与逆转录酶相结合,联合特殊设计的prime editing引导RNA,实现“搜索与替换”功能。质子编辑技术不仅能够实现单碱基替换,还能插入、删除更大规模的DNA片段,展现更为灵活的编辑手段。其通过引导逆转录酶将新遗传信息直接写入DNA,从而避免传统修复机制带来的不确定性。质子编辑已在2024年启动针对慢性肉芽肿病的临床试验,尽管随后治疗策略有所调整,转向囊性纤维化等疾病,但这一技术代表了未来基因治疗的方向——兼具高精度与多样性。 桥RNA系统(bRNA)是一项近期新兴的基因编辑技术,其不同于CRISPR系统的核心优势在于不依赖细胞的天然DNA修复机制,而是通过RNA引导的重组酶实现大片段DNA插入、倒位和切除。
该系统由两个重组酶和一条具有双环结构的bRNA组成,能够识别特定目标位点并执行精准重组。bRNA技术首次由Patrick Hsu实验室于2024年揭示,且已初步实现人体细胞中的功能。尽管目前尚未进入临床阶段,但其无需依赖双链断裂的独特机制提供了更高的编辑准确性,预示着基因组工程的新纪元。 随着技术的进步,越来越多的基因组编辑工具被发掘和优化,包括结合Cas9和bRNA特性的新型TIGR-Tas系统。TIGR-Tas不受PAM限制,含有独特的双向向导RNA,具备双链DNA靶点识别能力,拓宽了编辑 Target位点的多样性和灵活性。这种多样化的发展趋势显示出基因编辑工具箱正由早期简单的“锤子”转变为集精准度、高效性、多功能于一体的多元化组合。
在临床转化方面,Casgevy作为首个获得FDA批准的CRISPR基因治疗产品,已成功应用于治疗镰状细胞贫血和β地中海贫血,开启了基因编辑进军临床的序幕。尽管目前此类疗法依赖体外编辑患者细胞后再回输,成本高昂且门槛较高,但新兴在体内直接编辑的临床试验正在展开,利用纳米脂质颗粒和包膜介质等先进递送手段,提高递送效率并降低免疫反应风险。未来,随着递送技术的提升和基因编辑精度的加强,基因治疗有望实现更广泛的临床应用。 在农业和环境领域,基因编辑也展现巨大潜力。利用CRISPR改良的芥菜消除苦味,基因编辑黑莓实现无籽特性,甚至提高番茄维生素D含量等创新产品已进入市场。同时,科学家通过编辑杨树基因降低木质素含量,提高木材纤维利用率,为可持续发展和资源节约提供了新思路。
基因组编辑的广泛应用预示着它不仅能够改变医学生态,更将深远影响食品安全和环境保护。 回顾过去十余年,基因编辑工具经历了从单一蛋白质到多样化复杂体系的演变。研究者们不断发掘新型基因编辑酶,结合不同的靶向机制和修复路径,致力于实现更加精准、安全且便捷的基因改造技术。无疑,随着科学家对天然及人工基因编辑系统理解的加深,未来将涌现更多具特异性、效率高、脱靶低的创新工具,推动基础研究、临床治疗和生物工程迈向新高峰。基因组编辑的未来充满无限可能,每一次技术革新都向实现定制化、精准化医疗进发了一大步,兑现了改变生命的承诺。