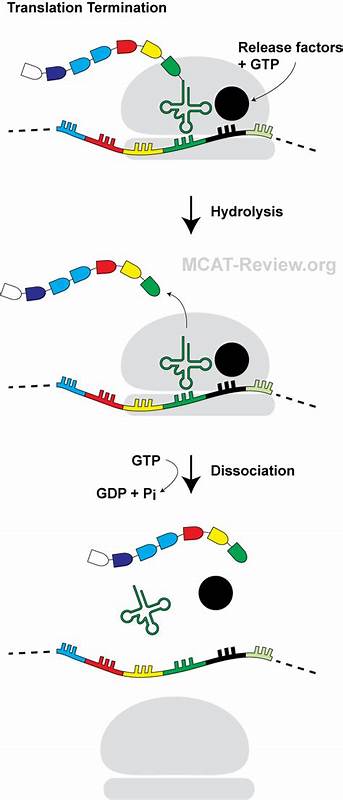
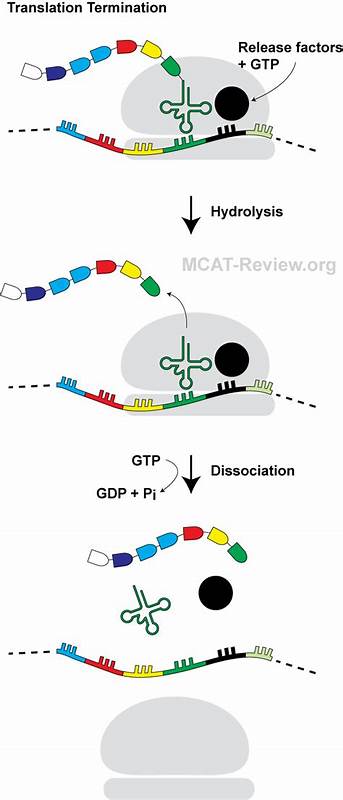
蛋白质合成作为细胞生命活动中的核心环节,其复杂且精密的调控机制长期以来备受科学界关注。近期研究发现,一种由14个氨基酸组成的迷你发卡型肽(mini-hairpin peptide)能通过独特的方式阻断翻译终止过程,为理解翻译调控提供了全新的视角。本文将深入解析迷你发卡肽阻断翻译终止的机械原理、其在核糖体中的特殊结构定位,以及该机制对基因表达调控的潜在影响。 在细胞内,蛋白质的生物合成由核糖体催化,将mRNA上的密码子依次翻译成氨基酸序列。翻译过程中,当核糖体遇到终止密码子时,释放因子能够准确识别并促使肽链从tRNA上水解,从而完成翻译终止。然而,某些新生肽链在合成过程中,会与核糖体出口隧道内的rRNA和蛋白质发生特异性相互作用,诱导翻译停滞甚至终止,从而参与基因表达的精细调控。
迷你发卡肽PepNL正是这样一种具有分子调控功能的小肽。通过系统性筛选和质谱分析,PepNL被证实能够在终止密码子处诱导翻译停滞。据高分辨率冷冻电镜(cryo-EM)结构解析,PepNL在核糖体出口隧道内形成了罕见的迷你发卡结构,其中肽链的N端折回朝向肽链出口附近的核糖体P区。这种异常折叠不仅稳定了肽链构象,还导致肽链后段发生显著的空间扭曲。 这种特殊构象的肽链直接阻碍了释放因子RF2中关键的GGQ催化基序进入肽酰转移酶中心,妨碍了终止反应的正常进行。原本应当插入以切断肽链与tRNA结合的GGQ序列,因为肽链扭曲的侧链形成了空间冲突,无法正确就位,造成释放因子处于非活性构象并延迟肽链释放。
核糖体的这一转变抑制了翻译终止,导致肽链的释放延迟并最终诱发翻译停滞。 PepNL的这一翻译阻断机制区别于已知的感应型翻译暂停肽(sensory arrest peptides),后者往往依赖特定代谢物作为诱导因子促使肽链与核糖体隧道结合并触发停滞。然而,PepNL能够凭借自身的氨基酸序列独立形成稳定的发卡结构,实现翻译终止的阻断。更有趣的是,PepNL的这种停滞状态可以被组氨酸运载RNA(Trp-tRNATrp)结合终止密码子U GA引起的读穿(read-through)逆转。换句话说,细胞环境中特定的转运RNA水平调控着PepNL诱导翻译停滞的开关状态,实现对蛋白质表达的动态调节。 进一步的分子生物学实验证明,在缺乏色氨酸或者Trp-tRNATrp的体外翻译体系中,PepNL能够强烈诱导终止位点核糖体停滞;而当色氨酸补充充足时,读穿率显著提高,PepNL引发的停滞被有效解除。
这说明时间因素十分关键:PepNL的发卡结构需要一定时间形成,若Trp-tRNATrp能在结构稳定前介入核糖体导致读穿,则停滞不会发生;反之,结构形成后阻断终止过程,形成翻译阻滞状态。 这一发现对于理解翻译延伸和终止机制提供了重要启示。首先,迷你肽链对核糖体出口通道内空间结构的适应性折叠表明,肽链本身就具有显著的结构调控能力,能通过折叠改变核糖体的功能状态。其次,肽链与释放因子之间的直接空间排斥,提示翻译终止不仅仅依赖于密码子和释放因子的简单识别,还受新生肽链结构状态的复杂影响。最后,利用密码子读穿机制作为调节停滞的“关闭开关”彰显了翻译过程中多层次、多因子相互作用的调控网络。 PepNL及其同类的迷你发卡肽不仅在基本的分子生物学研究中具有重要意义,其对基因表达的调控潜力还可能影响细菌环境适应与代谢调节。
例如,pepNL基因邻近编码PepN的区域,PepN蛋白作为一种氨肽酶,其活性与细胞内氨基酸平衡紧密相关。PepNL诱导肽链停滞的机制或可被视为感知和调节细胞内色氨酸代谢的一种反馈机制,从而优化细胞在不同环境下的能量资金和蛋白质量管理。 现代质谱技术和冷冻电镜技术为深入揭示类似小肽调节机制提供了强大工具。通过系统筛选潜在的小开放阅读框(sORFs)并结合高灵敏度的蛋白质组学分析,实验人员陆续发现数十种能够诱导翻译停滞的新型肽类分子。PepNL和另一种NanCL是其中的典型代表,它们在细菌内部实现不同的调控作用,标志着我们对翻译调控的认识已经进入了一个新的阶段。 未来的研究将聚焦于解析PepNL这类肽链停滞因素如何与细胞信号通路、代谢状态及环境应激因素相互整合,影响细胞命运。
同时,更广泛的功能分析将帮助揭示这些小肽对抗生素耐药性、应激反应和细胞生长调节等方面的潜在影响。 总结而言,迷你发卡肽PepNL通过形成独特的发卡结构,阻断释放因子RF2催化活性,实现翻译终止的抑制。这一机制区别于传统的感应型翻译暂停肽,且可被特定的读穿机制调控,揭示了蛋白质合成过程中的全新调节模式。随着更多调控性小肽的发现,这一领域将极大丰富我们对转录后调控、核糖体功能调节以及基因表达网络的整体理解,推动新型分子靶点的开发以及合成生物学在细菌系统中的应用创新。