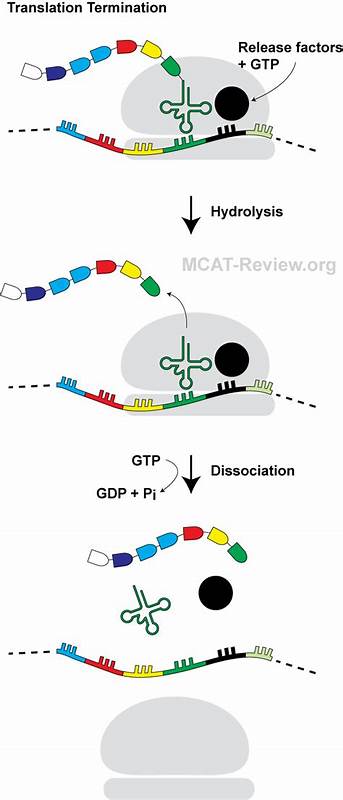
蛋白质的合成是生命活动中的关键过程,涉及细胞内遗传信息的准确转录和翻译。翻译过程的终止部分,通常由释放因子识别mRNA上的终止密码子并触发肽链释放,是确保蛋白质合成完整性的重要环节。近年来,科学家们开始揭示一种令人惊叹的现象,即一些新生肽链不仅是蛋白质功能的载体,它们本身还能通过特定的结构折叠,调控翻译过程。尤其是一种被称作“迷你发卡肽”的短小肽链,其通过独特的分子构象阻断翻译终止,为理解蛋白质合成的复杂调控机制带来了全新视角。 迷你发卡肽最早在大肠杆菌中被发现,它仅由14个氨基酸组成,却能精准地在终止密码子处引发翻译停顿。这种停顿并非机械化的错误,而是一种高度调控的生物现象,反映了细胞对翻译质量和效率的精密控制。
迷你发卡肽独特的结构机制是它调控功能的关键。通过冷冻电镜研究发现,这段肽链在核糖体出口隧道内折叠成迷你发卡形态,其N端异常地朝向隧道入口处折叠,构建了一个稳定的三维微环境。这种折叠不仅改变了肽链自身的空间构型,也诱导了核糖体的关键部位发生构象变换,特别是释放因子RF2的GGQ催化基序无法正确插入肽酰转移酶中心,导致翻译终止被有效阻断。 与传统的翻译调控因子不同,迷你发卡肽的翻译阻断不依赖于外部分子或代谢物作为诱导剂,这种“免诱导”特性使其在细胞内能自主完成翻译调节,反映出其高度内在的调控潜力。然而,这种机制并非完全不可逆。研究表明,细胞内的色氨酰tRNA参与解禁这一停顿事件,通过识别UGA止码子的色氨酰tRNA促进翻译延续,即所谓的“终止密码子读穿”机制。
这种机制允许细胞根据色氨酸供给和代谢状态,灵活调控翻译终止,使蛋白合成呈现出动态适应性。 在具体分子层面,迷你发卡肽与核糖体23S rRNA形成多重亲水和疏水相互作用,特别是与多个保守核苷酸发生稳固的结合,确保肽链形成规范的迷你发卡构象。此结构不仅稳定,还产生了对RF2接入肽酰转移酶中心的物理阻碍,这种阻碍引起释放因子构象的剧烈重排,使其处于非活化状态。释放因子的这种非典型构象稳定存在,进一步阻止肽链的释放,进而实现翻译的终止抑制。 迷你发卡肽的发现挑战了人们对核糖体功能单纯作为蛋白质合成工厂的传统认知。它展示了新生肽链不仅是被动产物,更是翻译调控的积极参与者。
调控翻译终止的这一机制在基因表达调节、蛋白质质量控制及细菌适应环境变化等方面具有潜在重要意义。譬如,通过调控下游基因的表达,迷你发卡肽可能影响细菌对营养状况的响应,进而调节细胞代谢和生存能力。 此外,迷你发卡肽的结构和机制也为合成生物学及抗菌药物设计提供了新思路。设计具有类似迷你发卡结构的肽段,或模拟其阻断释放因子的方式,有望研发出特异性的翻译调控工具,甚至开发新型抗菌剂,针对细菌蛋白质合成的终止环节实现精准干预。 从更广泛的视角来看,迷你发卡肽的研究突显了短小开放阅读框(sORFs)及其产物多样功能的重要性。传统基因组注释往往忽略这些小肽,而现代组学和结构生物学结合的研究策略正逐步揭示它们隐藏的调控网络和生物学价值。
未来,系统探索不同物种中的迷你发卡肽及其他新生肽的结构功能,将显著促进我们理解翻译调控的多样性和进化适应机制。 总之,迷你发卡肽通过其独特的发卡结构实现对翻译终止的精准阻断,展现了新生肽链多功能的分子调控潜力。这一机制不仅丰富了蛋白质翻译领域的知识体系,更为调控基因表达和生物技术应用提供了崭新的视角和工具。随着相关研究的深入,迷你发卡肽及其调控网络必将成为分子生物学和生物医药领域的研究热点,引领未来创新发展的浪潮。