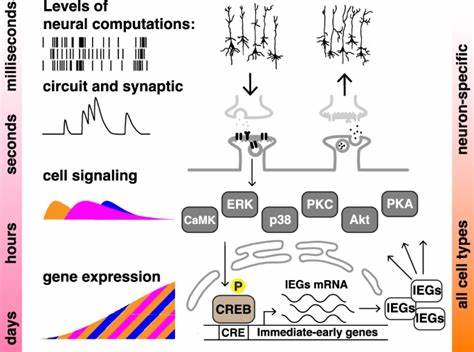
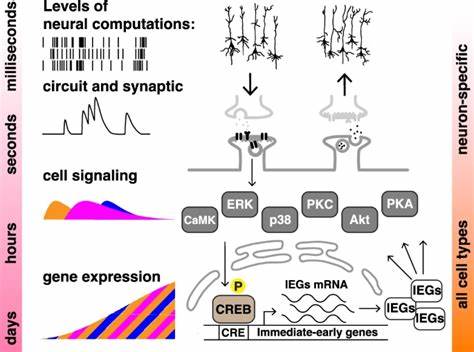
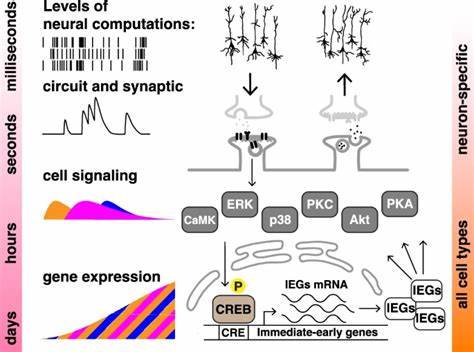
学习与记忆是生物体适应环境和生存的关键能力,尤其在人类神经系统中的表现已经被广泛研究和理解。集中学习(massed learning)与间隔学习(spaced learning)效应,是记忆形成领域的经典现象,表明分散训练往往比一次性大量训练更有利于长期记忆的形成。虽然这一现象传统上被视为神经系统特有,但最新科研突破却揭示了这种效应不仅存在于神经元层面,还在非神经细胞中显现,推动了我们对“细胞认知”概念的重新认识。近期由N.V. Kukushkin等科学家在《自然通讯》发表的研究工作,首次在两种非神经的人类细胞(SH-SY5Y神经母细胞瘤细胞系和HEK293胚肾细胞系)中重现了集中与间隔学习效应。该研究采用了融合CREB依赖性启动子的快速降解型荧光素酶报告系统,模拟学习过程中的“训练”,通过在细胞中周期性施加激动剂刺激并测量报告基因表达,展示了“记忆”形成背后的细胞生物学基础。研究人员利用福斯可林(Forskolin)和十二烷酰酯酰基苯酯(TPA)分别激活细胞内的蛋白激酶A(PKA)和蛋白激酶C(PKC)通路,这两条信号通路作为神经元记忆形成的重要分子工具,借由非神经细胞展现出类似行为。
训练采用短暂而重复的激动剂脉冲,时间间隔(ITI)的设计使得研究者能够比较单次长时间刺激(集中)与多次间隔刺激(间隔)对基因表达的影响。结果显示,四次间隔刺激显著增强和延长了荧光素酶表达的水平,相较于单次集中刺激所诱导的表达更为持久且更强烈。且这种差异在24小时后尤为明显,体现出时间分布的刺激不只是瞬时增强信号强度,更能减缓信号衰减速率,从而支持细胞层次的“记忆”形成。这一点模拟了动物行为学中的“遗忘曲线”,即重复学习能改善记忆保持时间。此外,研究还深入探讨了间隔学习效应与关键分子调控之间的联系,发现ERK(细胞外信号调节激酶)和CREB(cAMP响应元件结合蛋白)的磷酸化水平在间隔刺激组中显著高于集中刺激组。ERK作为连接外部信号与转录控制的关键枢纽,其活化状态决定了下游基因表达的开启情况,而CREB作为转录因子的激活与否直接影响立即早期基因(IEGs)的表达,这些基因在记忆巩固中肩负重要职责。
ERK的核内转位同样被发现在间隔训练中更为明显,说明其信号传递效能获得提升。这些分子层面的发现不仅验证了细胞级别对刺激时间模式的识别能力,还展示了复杂信号网络中多层次调控的整合性。为确证这一效应的分子机制,研究将ERK抑制剂U0126及CREB转录活性抑制剂666-15引入细胞训练过程中,发现两种抑制剂均能有效阻断间隔刺激带来的荧光素酶表达增强,表明ERK和CREB的持续磷酸化及转录活性是维系间隔学习效应不可或缺的分子基础。此外,CREB的活性受阻后,其自身的磷酸化水平和蛋白稳定性亦下降,暗示着复杂的正反馈及调控机制存在于这条信号通路中。相关实验进一步在非神经的人类HEK293细胞中得到了重复验证,表明该现象普遍存在且不依赖于任何神经专有性质,而是根植于广泛保守的细胞信号机制。科学意义上,这一发现彻底打破了传统神经中心论,提出记忆形成可以视为一种基于信号通路动态的细胞级计算过程。
所有细胞无论神经与否,均拥有解读外部环境信息并转化为持久内部状态变化的能力,这是生物信息处理的普遍原则。未来,这一研究方向不仅有助于深入解析细胞信号网络的时序识别机理,还为高通量、可编程的细胞模型提供了实验基础,有望推动记忆机制相关疾病的治疗策略革新。同时,这一细胞认知的新思路将为认知增强、学习效率优化等领域开启新视角。通过在细胞层面模拟复杂行为学现象,科学家能够更迅速、高效地进行药物筛选与机制探索,大幅降低传统神经元培养或动物研究的排他性限制。研究也建议未来关注不同细胞类型间记忆相关机制的异同,探索跨细胞信号通路的协同作用,完善分子层次的学习模式建模。此外,揭示PKA和PKC各自独特的时间调谐特性暗示多重信号融合在记忆时序上的深度影响,激励着对相互作用机制的综合阐释。
整体来看,非神经人类细胞中的集中与间隔学习效应代表了细胞信号网络处理时间模式的能力,这种能力蕴含着细胞对信息编码、转换与存储的高度动态性,有望革新我们对生物记忆本质的认识。未来,伴随着技术的进步与多学科协作,细胞层面的“认知”研究不仅将丰富基础生命科学的理论体系,也将孕育新型生物医疗方案,推动智能生物工程及合成生物学在认知领域的创新应用。