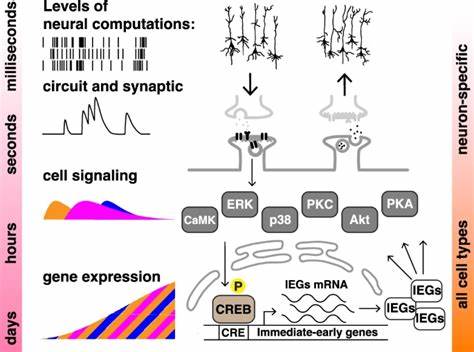
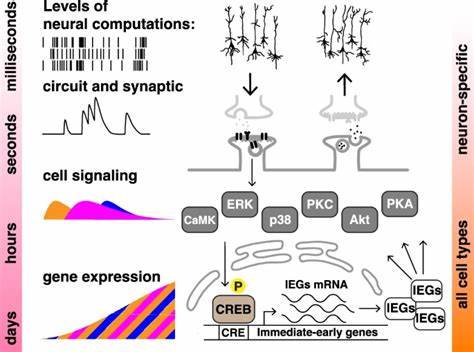
学习与记忆是生物体适应环境、传承经验的核心能力。传统认知理论和神经科学研究长期将这些现象局限于神经系统之中,认为复杂的神经回路和突触可塑性构成了记忆形成的基础。然而,近年来一项开创性的研究表明,甚至非神经人类细胞也能够展现出学习中经典的聚集-间隔效应,这一发现拓展了我们对“细胞认知”的理解边界,提示细胞层面的信号传导网络具备对时序信息的识别和长时记忆存储能力。聚集-间隔效应是在认知心理学中被公认为记忆巩固的关键现象,指的是将学习刺激分散在多次间隔的训练(间隔训练)往往比一次连续的训练(聚集训练)更容易形成持久而有效的记忆。虽然这一现象在动物行为实验和神经元层面的分子研究中屡获证实,最新研究将该效应观察定位至无神经性质的人体细胞系,为学习记忆机制注入了新的活力。研究团队基于人类神经母细胞瘤SH-SY5Y细胞系,构建了一种以CREB依赖型启动子的短寿命萤火虫荧光素酶报告系统(简称CRE-luc),作为细胞响应即时转录活动的代理指标。
继往开来的设计巧妙地利用了激活PKA和PKC信号通路的化学激动剂福斯可林(forskolin)和十二烷酰基酚酞酸三乙酸酯(TPA),模拟神经元中的学习训练脉冲,进而探究训练的时序对细胞记忆表型的影响。实验结果令人振奋,多个间隔10至30分钟的刺激脉冲使CRE依赖性转录活性显著提升,相较于单次连续刺激,间隔训练不仅引发更高强度的萤火虫酶表达,还延长了其表达持续时间。此现象在不同浓度和组合的刺激剂中均被观察到,且最优间隔时间体现了PKA和PKC两条信号路径对时序感知的微妙调整。更为重要的是,这种间隔效应不仅显著激活了ERK和CREB等关键的分子记忆元件,还被第一级信号通路的抑制剂阻断,进一步确认了ERK和CREB信号层级在非神经细胞中对时间模式的计算功能。细胞水平的Western印迹和免疫荧光检测显示,间隔刺激导致ERK的磷酸化及其向细胞核的转位明显强化,这暗示着非神经细胞借由时间窗的调制,实现了信号强度和持续性的编码。此外,CREB的磷酸化动态和总体蛋白质表达也随着策略性的训练模式演化,显示出基因转录层面的复杂调控与反馈。
研究还拓展到另一完全非神经来源的HEK293肾细胞中,同样观察到类似的间隔学习效应,表明这可能是一种普遍的细胞现象,而非神经系统特有。关于机制层面,持续且相互依赖的ERK和CREB活性被认为是维系长期转录记忆的核心。实验药物U0126和666-15分别针对ERK激酶活性和CREB转录结合功能的抑制,显著削减了间隔训练下的CRE驱动转录激活,阐释了分子反馈网络如何协同打造细胞的“记忆”存储。此前的研究认为诸如PKA调节亚基的降解、PKC特异形式PKM的合成及活性维持、以及CREB调节因子的多层次正反馈都可能参与了这一看似简单却极富动态复杂性的现象。此外,非神经细胞的周期性分裂与代谢背景亦可能赋予其不同于神经元的转录维稳特征,使得转录记忆能够在细胞代际间维持一段较长时间。此研究成果不仅挑战了传统神经中心论,更揭示了细胞层级普适的时间信号整合能力,为记忆与学习的分子基础研究准备了全新的非神经细胞模型。
该模型提供了高通量、易操控和可量化的优势,极大推动我们将复杂神经回路层面的认知理论抽象至更基础的分子网络层次。未来这条研究思路有望建构数学模型解析信号级联与时间编码的关系,助力认知增强、记忆障碍治疗与合成生物学设计。深入理解非神经细胞如何处理时间信号,将拓展我们对“细胞智能”与环境适应的认识,促进从神经科学到细胞生物学、再到信息科学的跨学科融合。随着分子工具和单细胞成像技术持续进步,科学家们能够揭示细胞分子机制背后蕴含的沟通和计算逻辑,或许未来的智能医疗甚至生物计算设备都能借力于此类普适的生物时间编码模式。简言之,非神经人类细胞中的聚集-间隔学习效应既为记忆形成提供了新的实验平台,也带来了挑战现有认知框架的机遇。记忆,不再是神经元的专属。
细胞信号网络的复杂时间动态或是原始的学习机制来源,等待我们持续探索与发掘。在迈向全面理解智能生命过程中,解码细胞级时间学习效应的重要性无可替代,着眼于分子级信号传递的节律与反馈,将不断揭示生命的智慧根基与拓展其技术应用的无限潜力。