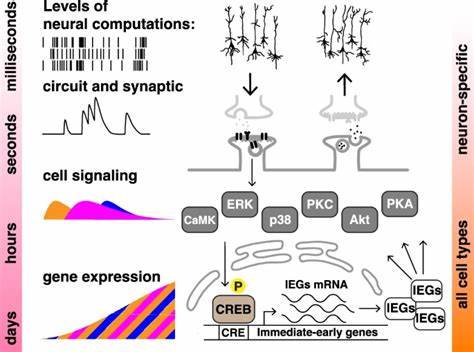
学习和记忆一直被认为是高度依赖神经系统的复杂功能,尤其涉及神经元之间的突触连接和神经回路。然而,最新的科学研究表明,记忆形成的一些经典特征,尤其是集中-间隔学习效应(又称间隔效应),不仅存在于神经系统,也可以在非神经的人类细胞中发现。这一突破性发现扩展了我们对“细胞认知”以及信息处理机制的理解,提示细胞可以在没有神经回路的条件下,利用信号传导通路实现类似记忆的动态过程。集中-间隔学习效应是指将学习内容分成间隔时间的多个训练阶段(间隔训练),比一次性长时间连续学习(集中训练)能获得更强且更持久的记忆效果。在神经科学领域,这一效应已被广泛研究,现如今,研究者尝试将该效应复制于非神经细胞模型,以明确细胞层面信号机制的普适性。 一项发表于2024年的开创性研究通过构建稳定表达携带CREB依赖启动子的短寿命萤火虫荧光素酶报告基因的两种非神经永生化人类细胞系,实现了对这一效应的再现。
研究团队模拟学习训练过程,向细胞施加多次短时激活剂刺激脉冲(激活蛋白激酶A和蛋白激酶C信号通路),通过检测各时间点的荧光素酶表达水平作为记忆的代理指标,明确显示间隔脉冲相比单次集中脉冲能诱导更强烈且更持久的基因转录反应。 研究中特别选择了人类神经母细胞瘤SH-SY5Y细胞系和胚胎肾HEK293细胞系,分别构建了含cAMP反应元件(CRE)控制的荧光素酶报告系统。研究利用激活腺苷酸环化酶的福斯科林(forskolin)和激活蛋白激酶C的四烷酰基酚酯(TPA)作为模拟神经调节信号的化学激动剂。经过四次10分钟间隔的短暂刺激,荧光素酶的表达不仅比单次刺激高出约1.4倍,且在24小时后依然维持较高水平,而单次刺激导致的表达则迅速下降,展现出典型的间隔学习优势。此外,不同的间隔时间会影响激活的强度,显示出蛋白激酶A和蛋白激酶C对时间间隔的敏感性存在差异,这指向了细胞内信号网络中对时间模式的解码机制。 在分子层面,细胞内ERK与CREB的磷酸化水平被证实是调控这一效应的关键,四次间隔脉冲诱导了ERK与CREB显著更强烈的活化,且其核内转位更为明显,揭示信号转导和转录调控环节的同步增强。
阻断ERK磷酸化(使用U0126抑制剂)或抑制CREB的转录活性(使用666-15抑制剂)均会消除间隔学习效果,进一步确证这些信号因子在信息时间依赖性处理中不可或缺。 这一发现不仅挑战了传统观念,即复杂的学习记忆功能必须在神经系统内实现,还强调了一些信号传导机制的高度保守性和广泛应用性。非神经细胞利用PKA和PKC激酶的活性调节ERK和CREB,进而影响基因表达的动态调控,表明细胞层面即存在能响应时间模式化训练刺激的“生物时钟”,从而实现特定的记忆般反应。 此外,研究揭示了蛋白激酶A对刺激时长尤为敏感,而蛋白激酶C对脉冲次数更敏感的区别,为生物节律和学习时序的调控机制提供新的视角。该机制与神经元中的学习记忆模型高度相似,暗示经典神经可塑性的分子基础,其实是细胞信号网络中的基本属性。 运用非神经细胞模型研究学习记忆效应,除了解开细胞层信息存储的基本原理外,也展现了极大的实验优势。
非神经细胞的无限增殖能力和简便的培养条件提供了高通量、高精度追踪分子变化的平台,未来有望建立精确数学模型,预测和优化记忆形成过程,为神经退行性疾病和认知障碍的疗法研发提供新的入口。 该研究进一步支持“细胞认知”概念,即所有细胞均具备解析环境信号并将短时刺激转化为长期稳定响应的能力。细胞不仅是代谢和结构的单位,更是具备复杂信号处理功能的信息系统。诸如蛋白激酶相关的持续活性机制、正反馈信号环路和转录因子调控网络共同塑造了这一功能。 综合来看,非神经人类细胞中观察到的间隔学习效应重塑了我们对记忆机制的理解,强调了细胞内信号通路对时间模式的解码能力,以及其在生物信息存储中的重要作用。这为认知科学及细胞生物学的交叉研究开辟了新路径,也为未来开发基于细胞信号调控的认知提升技术奠定了基础。
展望未来,解析如何通过调节训练间隔时间优化细胞记忆形成将成为关键议题。同时,深入研究CREB和ERK之间的正反馈调节网络,及其在不同细胞类型乃至整个生物体层面的信息编码角色,也将有助于推动现代神经科学与系统生物学的发展。通过对这些基本机制的深入探索,或许终有一天我们可以设计智能化细胞系统,实现精准调控记忆和学习过程,为医学和人工智能领域带来革命性的影响。