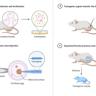
哺乳动物通常依赖于来自父母双方的遗传物质才能正常发育和繁育后代。传统观念认为,单一亲本的遗传基因组,尤其是完全来自雄性的精子,难以支持胚胎的正常发育,主要原因源于基因组印记(genomic imprinting)的存在。基因组印记是一种表观遗传调控机制,控制着部分基因的单等位基因表达,对胚胎发育和基因的父母效应有着关键性作用。近日,科学界迎来了一项里程碑式的突破——研究人员通过靶向表观遗传编辑技术,成功生成了由两枚精子遗传物质构成、可健康生育的成年小鼠,这在哺乳动物学和辅助生殖领域具有深远意义。传统的科研认知指出,来自父系的单独基因组无法支持哺乳动物的完全发育,这是由于多个印记调控区(Imprinting Control Regions,ICRs)维持着父母基因组间复杂的表达平衡。毫无母亲遗传参与的遗传构成,早期多次尝试均未能产生可成活的胚胎或成鼠,因此推动双亲基因组间表观遗传平衡的调控成为了破解哺乳动物单亲繁殖难题的关键。
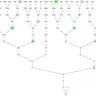
最新的研究采用了CRISPR基因编辑技术中的表观遗传学变体,特别是通过精准的DNA甲基化修饰,实现了针对七个印记控制区的高效修改。科学家选用了两枚精子,先将其注入去核的卵细胞,使胚胎形态上成为二倍体,随后通过设计特异性的导向RNA进行等位基因密码序列针对性编辑,绕过了自然的基因组印记障碍。此次实验的成功,不仅表明通过改变印记区的表观遗传状态,可以重建父系基因组的功能性平衡,还证明了两枚精子结合后的胚胎完全有能力发育为健康、具有生育能力的成年个体。这项技术的核心优势在于其高效且可控的基因组印记重塑,避免了以往因基因缺失或异常导致的胚胎停育或发育异常现象。同时,研究团队验证了这些“雄性单亲”小鼠不仅存活率达到正常水平,还能成功交配繁育后代,体现了其完全的生物学功能。该突破性进展对解开哺乳动物繁殖机制的复杂性及基因表达调控提供了新的视角。
基因组印记作为阻碍单亲遗传发育的根本机制,被实验证明可以通过表观遗传工具进行逆转和调控,为未来可能实现的无母生育或单亲繁殖补充了强有力的科学依据。此外,这种技术为辅助生殖医学带来了前所未有的潜力,尤其是在不育症治疗、多重遗传病预防及胚胎发育异常的干预方面,提供了创新解决方案。尽管目前这项技术主要应用于小鼠模型,未来在伦理和安全性层面尚需深度考量,但毋庸置疑的是,它推动了跨物种基因组调控和重编程研究的进步,或许能催生符合人类临床需求的新型生殖辅助策略。科学家们期待将来能进一步完善相关技术,探索不同印记基因调控的精细机制,实现更广泛的物种适用性和生殖健康保障。这一发现标志着生物学与医学领域完成了一次前沿性的跨越,彰显了现代基因编辑手段在解锁生命奥秘中的巨大潜力。未来对印记基因与表观遗传调控的深入研究,将极大地扩展我们对生命起源和个体发育的认知边界,促进多学科技术融合发展。
综上所述,利用双精子并通过靶向表观遗传修饰实现可育小鼠的诞生,不仅突破了哺乳动物单亲繁殖的瓶颈,更为基因组印记调控提供了新的实验范式。该领域的持续进展必将为生殖科学、人类疾病防治和生物技术产业带来前所未有的机遇和挑战,推动生命科学研究迈向新的高度。