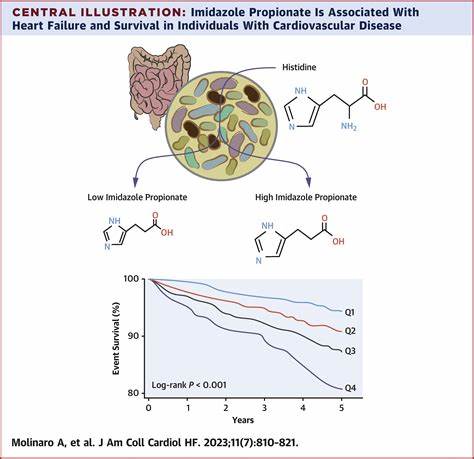
动脉粥样硬化作为全球范围内心血管疾病的主要致死原因,长期以来困扰着医学界。虽然传统的治疗手段主要侧重于控制血脂、降压以及抗炎等方面,但仍有大批患者在这些治疗下依然面临较高的心血管事件风险。近年来,肠道微生物组及其代谢产物逐渐成为研究热点,揭示了宿主与微生物代谢交互在疾病发生发展中的关键作用。组胺基丙酸(Imidazole propionate,简称ImP)作为一种由肠道微生物产生的代谢物,在动脉粥样硬化中的作用日益受到关注。最新的科学研究表明,组胺基丙酸不仅与动脉粥样硬化的病程高度相关,其通过激活免疫系统与促炎信号通路进一步推动疾病进展,也为早期诊断和治疗提供了全新的视角。研究首先在动物模型中发现,给予高胆固醇饮食的小鼠,其体内组胺基丙酸水平显著升高,且该代谢物的浓度与动脉硬化斑块的面积存在正相关。
而当给予抗生素以破坏肠道菌群后,组胺基丙酸的生成减少,动脉粥样硬化的程度也相应减轻,显示出该微生物代谢产物对疾病的直接影响。进一步实验中,科学家通过口服组胺基丙酸给与无菌小鼠,观察其动脉粥样硬化病变显著加重,表明组胺基丙酸本身具备促发动脉粥样硬化的能力,而这一效应并非由血脂变化引起,这一发现突破了以往认为血脂是动脉硬化唯一驱动力的框架。临床研究中,研究团队对超过400名无症状个体进行了组胺基丙酸的血浆检测,通过先进的多模态影像技术定位亚临床动脉粥样硬化病灶。结果显示,组胺基丙酸水平在亚临床患者中显著升高,且与动脉斑块的活跃度和炎症反应呈正相关。这一发现不仅在另一独立队列中得到验证,还显示该代谢物在疾病早期具有较高的诊断价值,有望成为心血管风险评估的新型生物标志物。关于机制层面,组胺基丙酸通过特异性结合宿主细胞中的Imidazoline-1受体(I1R,又称nischarin),引发下游mTOR信号通路的激活,促进单核细胞和T细胞等免疫细胞的活化与炎症细胞因子的释放,形成促动脉粥样硬化的免疫微环境 。
利用基因敲除技术,研究人员发现删除免疫细胞中特异性I1R表达后,组胺基丙酸诱导的动脉粥样硬化显著减轻,提示ImP-I1R轴在疾病机制中不可替代。更有意义的是,针对I1R的特异性受体拮抗剂AGN192403在高胆固醇饮食的小鼠中显示出阻断组胺基丙酸相关信号的能力,从而有效抑制动脉斑块的形成和炎症反应,而这一过程并不影响血脂水平。该结果不仅验证了ImP-I1R通路作为治疗靶点的潜力,也为非传统心血管疾病治疗提供了可能。组胺基丙酸的发现,揭示了微生物介导的代谢产物直接影响宿主免疫功能的新机制,并在心血管疾病发病中扮演了重要角色。传统心血管疾病风险评估依赖于临床指标和影像学检查,但组件复杂、易被混杂因素影响。集成微生物代谢产物检测和受体通路调控,能够更精准地揭示动脉粥样硬化的免疫代谢环境,有助于实现疾病的早期筛查和靶向干预。
与此同时,组胺基丙酸与饮食结构密切相关,尤其高蛋白饮食和某些西式饮食模式会促进肠道内关键微生物的组胺基丙酸生成。干预饮食结构以及调控肠道微生物生态,有望间接调控ImP水平,从而缓解动脉粥样硬化的风险和进展,这为未来联动饮食、微生物与药物的多模态治疗提供了思路。动脉粥样硬化作为一种慢性免疫炎症病理进程,肠道微生物代谢产物对其的影响强调了宿主与环境间高度复杂且动态的相互作用。研究表明,组胺基丙酸通过激活免疫细胞特定受体,进一步促进炎症反应,加速斑块形成,导致心血管病事件风险的增加。通过靶向ImP-I1R轴的药物研发,有望开发出具备高选择性、低副作用的新型抗动脉粥样硬化治疗方案。结合传统的血脂调控药物,此类疗法可能实现风险多靶向干预,更有效地防控心脑血管疾病。
除治疗潜力外,组胺基丙酸亦具备较强的疾病活跃状态指示作用,联合免疫指标可为临床医生提供精准的风险分层依据,提升个性化医疗水平。同时,组胺基丙酸检测的实现与应用,促使临床实践从单一生物标志物向多维度综合评估转变,推动心血管疾病管理向预防为主的方向发展。未来研究需进一步明确组胺基丙酸在不同人群中的生物学变异与遗传调控机制,探讨其与其他微生物代谢物的交互效应,以更全面构建肠道微生物-宿主代谢-免疫轴对心血管疾病的影响网络。同时,探索针对该通路的临床转化策略,包括安全性评价、药物剂量优化及长期疗效监测,将是促进这一领域迈向临床应用的关键。综上所述,组胺基丙酸作为肠道微生物代谢产物,已经被确立为动脉粥样硬化进展的重要驱动因子和全新治疗靶点。其通过I1R介导的免疫炎症调控开启了心血管代谢性疾病治疗的新篇章,为未来心血管疾病的早筛、防治提供了创新的科研参考和临床应用方向。
在全球心血管疾病负担持续上升的当下,聚焦组胺基丙酸及其信号通路,推动精准医疗与微生物组科学深度融合,必将为人类健康事业贡献更大力量。