艾滋病病毒(HIV)的潜伏感染一直是治愈该疾病的最大挑战之一。尽管抗逆转录病毒疗法(ART)在控制病毒复制、延长患者寿命方面取得了显著成效,但病毒一旦进入休眠状态,嵌入宿主细胞基因组中的潜伏病毒依旧能够躲避免疫系统及药物的清除,成为病毒复发的根源。近年来,生物医学领域致力于研发策略以逆转HIV的潜伏状态,实现病毒“惊醒”并被清除,从而朝向根治方向迈进。伴随着mRNA和脂质纳米颗粒(LNP)技术的飞速发展,科学家们开始尝试将这两种技术结合,针对难以转染的休眠CD4+ T细胞递送特定的mRNA,从而激活潜伏的HIV病毒,揭示潜藏的感染细胞。独特的纳米颗粒递送平台不仅显著提高了mRNA进细胞的效率,也极大减少了对T细胞的活化和相关的细胞毒性。 休眠CD4+ T细胞是HIV储存的主要场所,其沉默的病毒基因组不会表达病毒蛋白,避免了宿主免疫系统的监测与攻击。
传统的潜伏逆转剂(LRA)多为小分子化合物,虽然在体外和临床试验中能够诱导病毒部分转录活性,但由于其非特异性和毒性问题,尚未确切实现潜伏库的缩小。并且,部分LRA可能抑制关键免疫细胞的功能,减少被激活HIV感染细胞被清除的可能性。面对这一瓶颈,研发更具靶向性、低毒性且具备强大促转录功能的新型LRA显得尤为重要。 mRNA技术因其快速设计合成、表达可控以及无需整合宿主基因组的优点,成为精准治疗的新宠。结合LNP递送平台,尤其是近年来获得FDA批准的LNP技术,为mRNA的体内稳定递送和高效蛋白表达提供了保障。然而,休眠的CD4+ T细胞极难被传统的基因递送系统如病毒载体或电穿孔法有效转染,更不应该激活这些细胞以避免免疫激活带来的副作用。
因此,开发专门针对休眠T细胞设计的LNP配方,突破这一技术障碍,成为解决HIV潜伏问题的关键所在。 最新研究中,科学家们设计出一种新型LNP配方,命名为LNP X,这种配方在脂质成分中用SM-102代替了传统的DLin-MC3-DMA离子化脂质,并以β-谷甾醇代替胆固醇作为辅助脂质,显著提升了纳米颗粒与静息CD4+ T细胞的结合和内吞效率。实验数据显示,LNP X在不刺激T细胞预激活的条件下,成功实现超过75%的CD4+ T细胞mRNA转染,且细胞活力和活化状态未出现明显改变,刷新了此前认为休眠T细胞难以被有效递送的认知。与传统的patisiran类LNP相比,LNP X在转录水平的表达增强了6倍以上,这种转变归因于LNP X不仅增加了细胞表面吸附和摄取,还提高了进入细胞质后的mRNA翻译效率。 针对HIV潜伏逆转,研究团队将编码HIV核心转录激活蛋白TAT的mRNA封装入LNP X中,制成Tat-LNP X。TAT蛋白可结合病毒LTR区的转录激活响应元件(TAR),提升病毒转录过程中的延伸效率,从而强效激活病毒表达。
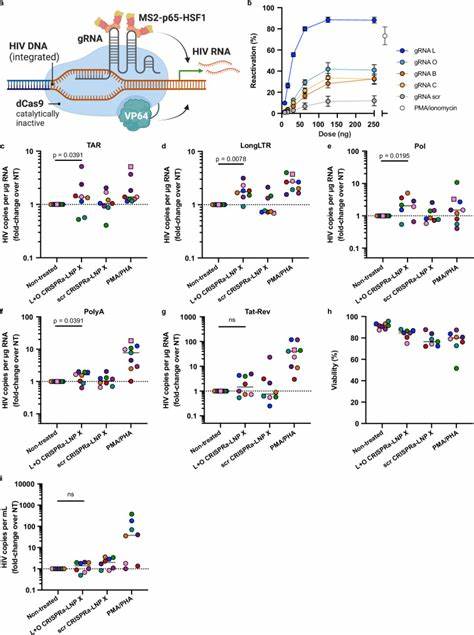
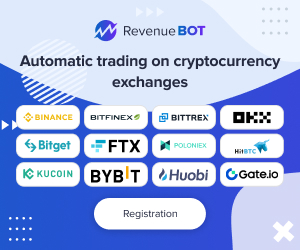
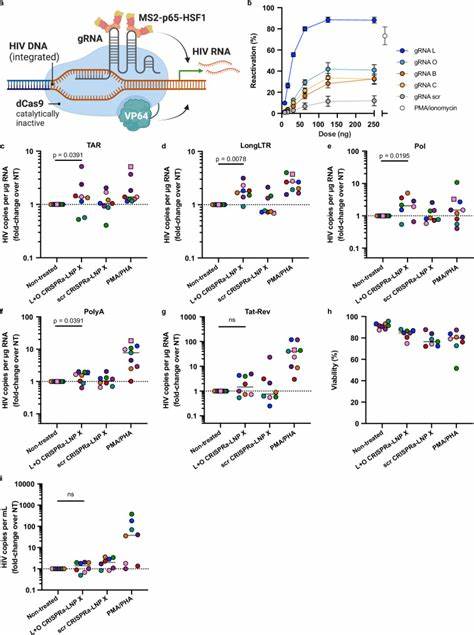
在休眠HIV感染模型细胞J-Lat 10.6中,Tat-LNP X处理显著诱导报告基因绿色荧光蛋白(GFP)表达,显示出令人瞩目的逆转潜伏活性。更重要的是,在来自抗逆转录病毒治疗抑制期HIV感染者的原代CD4+ T细胞中,Tat-LNP X表现出了超越传统MITOGEN(如PMA/PHA)诱导效应的潜伏逆转作用,激活了转录起始、延伸、剪接等多个关键步骤,且不引起细胞激活相关表面标志的表达增加,减少了免疫激活相关风险。 然而,Tat-LNP X诱导的潜伏逆转尚未见到潜伏库的DNA含量减少,提示单一的逆转策略恐难实现感染细胞的根除。这反映出潜伏感染细胞内的复杂生物学机制,如抗凋亡蛋白的表达、免疫清除的不足等,提示未来需要联合促凋亡或提升宿主免疫清除功能的方法。 另一重要策略为CRISPR激活(CRISPRa)技术,利用无切割活性的dCas9蛋白融合转录激活域,配合特异性导向的gRNA定位至HIV LTR启动子区域,直接激活病毒基因转录。团队基于LNP X递送平台,成功将dCas9-VP64、MS2-p65-HSF1及HIV LTR靶向gRNA联合封装,实现在未激活CD4+ T细胞中CRISPRa组件的有效递送和表达。
通过此系统调控内源基因CD25的表达,验证了LNP X递送CRISPRa的功能性和时效性。随后将靶向HIV LTR的gRNA应用于患者来源CD4+ T细胞,显著诱导病毒转录活性,展示出高特异性和较低细胞毒性,为靶向治疗潜伏HIV提供创新路径。 尽管CRISPRa-LNP的潜伏逆转效率目前低于Tat-LNP,但其极高的靶向性和低脱靶风险使其成为潜在的长期基因调控工具。未来的研究将聚焦于提升递送组件的比例优化、增强表达稳定性、联合免疫清除策略以及在体内递送的合理设计。 综上所述,高效的mRNA递送到休眠CD4+ T细胞,以实现HIV潜伏逆转,是艾滋病毒根治研究中的重大突破。LNP X配方凭借其出色的递送效率和安全性,展现出实现精准、特异、低毒的潜伏逆转治疗策略的巨大潜力。
将mRNA技术与CRISPR基因调控技术结合,未来有望实现对潜伏病毒的精确激活和清除,突破现有治疗瓶颈。 伴随进一步的安全性评估、体内递送机制研究以及联合免疫疗法的开发,该技术平台或将引领下一代HIV治愈方案的诞生。同时,LNP X的研发同样为DNA/RNA递送至其他难以转染的细胞类型提供了重要启示,有望拓展至多种免疫调节和基因治疗应用领域。科学界对mRNA-LNP疗法的持续关注和研发投入,将加速实现艾滋病治愈的宏伟目标,并惠及广泛的慢性病毒感染及遗传疾病治疗。