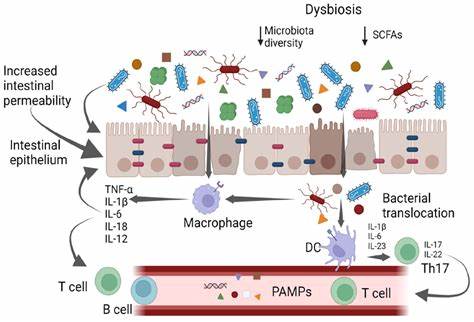
抗生素的广泛使用在现代医疗中发挥了极为重要的作用,成功治疗了无数感染疾病。然而,抗生素的使用同时也带来了肠道微生物群的严重扰动,导致微生物多样性降低,生态系统失衡。这种失衡不仅影响消化系统的正常功能,还可能引发一系列代谢、免疫和系统性疾病。如何在抗生素治疗后快速且有效地恢复肠道微生物群,成为当前科学界和医疗行业的重大课题。传统上,粪便微生物移植(FMT)被视为恢复肠道微生态的一种有效治疗手段,但近期研究表明,饮食干预在微生态恢复中表现出更为显著的作用,甚至优于微生物移植。本文将深入分析饮食对肠道微生物恢复的重要意义,为什么高脂低纤维的西方饮食限制了微生态的复原能力,以及合理膳食如何促进肠道健康和抵御病原体感染。
西方饮食通常包含高脂肪和低膳食纤维成分,这种饮食结构被证实会引起肠道微生物群的失调——表现为多样性显著下降和代谢功能缺失。这种现象称为微生物群失调症(dysbiosis),其后果不仅限于肠道本身,还会扩展至全身代谢紊乱和免疫系统异常。更为关键的是,高脂低纤维饮食使得肠道微生态在遭受抗生素干扰后难以迅速恢复,微生物群恢复缓慢、不完全,增加了继发感染的风险,包括致病菌如沙门氏菌的入侵和定植。科学家们通过小鼠模型比较了传统规范饮食(普通饲料)与西方饮食对抗生素后微生物恢复的影响,发现仅在摄入普通饲料的小鼠中,肠道微生物群能够经历一系列自然的、复杂的群落演替过程,迅速恢复其丰富的多样性和功能。这种恢复过程得益于肠道内微生物之间的合成代谢和互利共生关系,这种互惠作用促进了不同菌群的资源共享和代谢矩阵的完善。而在西方饮食条件下,一个或少数优势菌株会独占有限的资源,缺乏将代谢产物释放共享的行为,导致整体微生物群落功能单一且恢复迟缓。
值得关注的是,通过代谢建模和菌群相互作用网络分析,研究人员强调了饮食成分对微生物合成代谢网络的塑造能力,这种网络决定了群落的稳定性和抗干扰性。简言之,适宜的营养环境是微生物群自我修复的必需条件。尽管粪便微生物移植(FMT)作为一种直接补充健康菌株的方法,业界曾对其寄予厚望,但越来越多的证据表明,在不调整饮食基础环境的情况下,FMT效果有限,甚至有可能因营养环境不支持新菌群的生存而导致移植失败。研究中发现,饮食调整不仅是恢复肠道微生态的基础,更是一种安全、自然且易于实施的策略,尤其是在抗生素干预后。合理膳食提供的多样化纤维和低脂肪环境,创造了支持广泛菌群共存和互助的生态位,有助于防止病原体扩张,实现微生物多样性的稳步增长。此外,健康饮食还提升了宿主免疫功能,增强肠道屏障,进一步降低感染风险。
膳食纤维在其中扮演关键角色,它们被肠道特定菌群发酵产生短链脂肪酸,如丁酸盐,这些代谢产物不仅为肠细胞提供能量,还具有抗炎和免疫调节作用。相反,缺乏纤维的饮食削弱了这些重要生理过程,妨碍微生态的恢复和功能性重建。越来越多研究建议,治疗过程中应将饮食干预作为标准策略,配合甚至优先于微生物移植。特别是在抗生素治疗后,合理的膳食可促进微生态韧性和代谢网络的恢复,从而自然抵御病原菌定植和感染风险,减少对微生物移植的依赖和潜在风险。未来肠道健康管理的方向可能会更加注重个性化饮食设计,根据个体微生物群特征和恢复需求,制定精准营养干预方案。此外,结合功能分析和代谢建模,科学界能够更好地理解饮食成分如何塑造微生态结构,实现疾病预防和治疗的双重目标。
总体来看,饮食在抗生素后肠道微生态恢复中的作用不可替代。其通过优化营养环境,促进微生物多样性和代谢协同,强化宿主免疫功能,展现出比单纯微生物移植更优越的恢复效果。这一发现不仅推动了肠道微生物学的理论进展,也为临床实践指明了新的方向。未来,应重视饮食干预的推广与研究,以实现肠道健康的长期维护和疾病风险的有效降低。