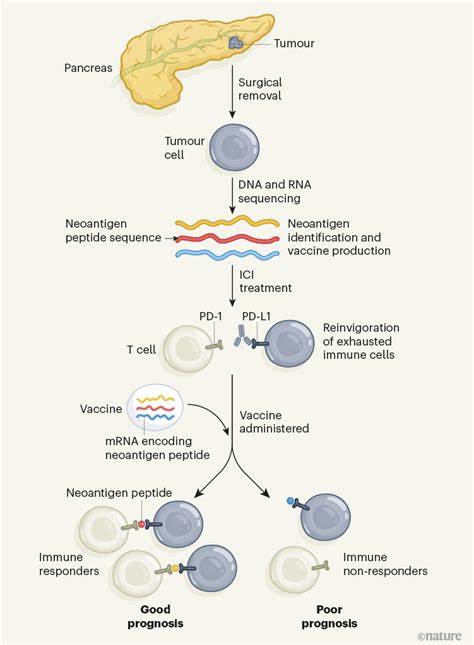
胰腺癌作为全球公认的恶性肿瘤之一,因其隐匿性强、发现晚、治疗效果有限,五年生存率常年徘徊在13%左右,成为肿瘤治疗领域最大的挑战之一。传统的手术切除、放疗与化疗在延长患者生命方面取得的成效十分有限,且往往无法实现彻底治愈。面对如此严峻的形势,科学家们亟需寻找全新的治疗策略,免疫治疗作为近年肿瘤治疗的革命性手段,受到极大关注。近日,美国凯斯西储大学(Case Western Reserve University)与克利夫兰诊所(Cleveland Clinic)的研究团队联合开发了一款基于纳米颗粒的胰腺癌疫苗,在临床前模型中展现出令人振奋的治愈潜力,标志着胰腺癌免疫疗法研究迈上新台阶。 该疫苗主要针对胰腺导管腺癌(PDAC),利用先进的脂质纳米颗粒技术将多种精挑细选的肿瘤相关抗原包裹,并高效递送至免疫系统中。这些抗原是肿瘤细胞上的分子标志,能够被免疫细胞识别并引发强烈的抗肿瘤反应。
凯斯西储大学的生物医学工程专家陆正荣教授以及免疫学家王丽莉副教授共同领导该项目,开创性地解决了胰腺癌肿瘤微环境免疫抑制的问题,使得原本数量稀少且功能受限的肿瘤特异性T细胞得以活化并扩增,显著增强了机体对抗癌细胞的能力。 脂质纳米颗粒作为载体的优势在于其良好的生物相容性和高效的抗原递送能力。纳米颗粒能够有效保护抗原免受体内酶解降解,确保靶向免疫细胞并促进其吞噬与处理,从而最大化免疫激活效果。此外,采用纳米技术还可降低疫苗引发的不良反应,提升患者耐受性。基于这些优势,该疫苗不仅提升了胰腺癌治疗的安全性,也提高了免疫反应的强度和持续性。 胰腺导管腺癌具有高度的遗传异质性,意味着肿瘤细胞中存在大量不同的突变类型,给精准治疗带来极大难度。
针对这一特点,研究者们设计了覆盖最常见致癌突变的多抗原组合,有效突破了个体化疫苗设计的局限,使疫苗成为可能适用于更广泛患者群体的“通用”治疗方案。这种策略不仅提高了治疗的普适性,也为未来大规模生产和推广奠定了基础。 在实验过程中,接受疫苗治疗的胰腺癌小鼠模型表现出惊人的治疗效果——超过半数的模型在数个月后完全无瘤存活,彻底清除了体内的恶性肿瘤细胞。这一突破性进展不仅为胰腺癌的治疗带来了新的希望,也向科学界展示了纳米技术与免疫治疗完美结合的巨大潜力。此外,疫苗还能诱导长期免疫记忆,这意味着机体能够对未来可能出现的肿瘤细胞持续保持监控,预防癌症复发或发生,具备显著的预防价值。 值得一提的是,研究团队计划将该疫苗与免疫检查点抑制剂联合使用。
免疫检查点抑制剂能够解除肿瘤对免疫细胞的抑制作用,释放T细胞的杀伤潜力。联合应用预计能产生协同效应,进一步提升免疫活性,增强治疗效果。此举或将突破胰腺癌免疫疗法历来的难关,为患者提供更为全面和有效的治疗方案。 研究资金方面,团队已获得美国国家癌症研究所(NCI)约327万美元的专项支持,正不断优化疫苗配方和用药方案。为确保新疫苗的安全性与有效性,下一步将在更多动物模型上开展全面的安全评价和剂量优化试验。成功完成这一阶段后,研发团队计划携手制药企业,迅速推进临床试验,争取早日实现从实验室成果到临床应用的转化。
该项目的多学科合作同样令人瞩目,整合了生物医学工程、免疫学、病理学和外科临床等多个领域的专家智慧。外科教授乔丹·温特(Jordan M. Winter)及病理学助理教授阿克拉姆·沙拉比(Akram Salah Shalaby)等临床专家为疫苗的开发和作用机制提供了关键的病理和临床视角,确保研究成果更具实践指导意义,并为未来的临床应用打下坚实基础。 这项研究不仅为胰腺癌患者带来了实实在在的希望,也为癌症疫苗技术的整体发展指明了方向。纳米技术驱动的免疫疗法结合精准设计的肿瘤抗原,正在成为下一代肿瘤治疗的核心动力。通过有效激活免疫系统来绕过肿瘤的免疫逃逸机制,该技术有望在包括胰腺癌在内的多种恶性肿瘤领域掀起治疗革命。 然而,尽管当前的研究成果令人鼓舞,仍存在诸多挑战亟待解决。
疫苗在人体中的长期安全性和免疫反应的个体差异性需进一步确定。同时,纳米颗粒疫苗的大规模生产和质量控制也对技术平台提出了更高要求。未来随着技术的成熟和临床数据的积累,这些难题有望逐步被攻克。 胰腺癌以其凶险难治著称,但随着纳米技术与免疫学的融合创新,攻克这一致命难题的希望变得触手可及。疫苗的成功研发不仅可能实现对胰腺癌的根治,更将开启肿瘤治疗和预防的新纪元,助力全球范围内提升癌症患者的存活率与生活质量。科学家们正不断努力,期待利用纳米疫苗技术推动胰腺癌从“绝症”向“可治愈”的节点转变,造福更多患者和家庭。
如今,癌症免疫治疗的未来正因这一创新研究而更加光明。