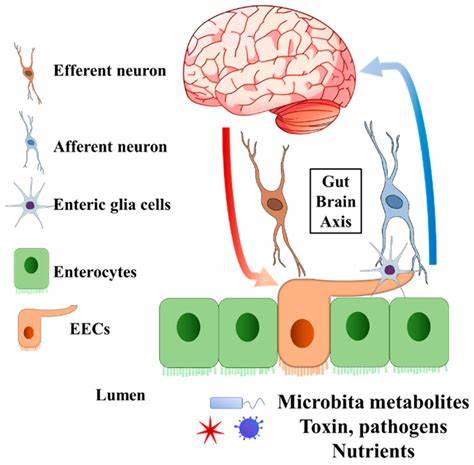
长期以来,科学界普遍认为健康大脑是一个相对封闭的环境,受血脑屏障的保护,免受外周免疫系统细胞的干扰和入侵。传统观点认为,除了大脑内固有的免疫细胞——小胶质细胞之外,其他免疫细胞只有在疾病状态或感染时才会进入大脑。然而,来自耶鲁医学院的一项开创性研究彻底颠覆了这一观念。科学家们首次发现,免疫系统中的关键战士——T细胞,实际上会稳定存在于健康大脑之中,且这些细胞并非随机存在,而是通过一个复杂的“肠-脂肪-脑”轴,从肠道经脂肪组织迁移到大脑的特定部位,执行独特的生理功能。T细胞是在人体免疫防御中扮演核心角色的细胞,它们不仅能够识别和清除病原体,还参与调节免疫反应和平衡免疫环境。过去,人们普遍将T细胞在大脑中的出现视为疾病感染或炎症的标志,但耶鲁的研究团队却发现,在没有疾病干扰的健康个体脑内,T细胞同样活跃存在,尤其集中在一个叫做“穹窿下器官”的脑区域。
穹窿下器官位于脑部明显深层,这一区域独特之处在于其血脑屏障的通透性相对较高,使其能够感知体内的生理状态,如渴觉和饥饿信号。研究人员推测,T细胞在此地的驻扎,可能具备传递身体内部状态的信号功能,帮助脑部更有效地调控机体需求。具体来说,实验显示,小鼠在断奶后随着饮食结构的变化,肠道微生物群(菌群)发生明显转变,这种变化促使T细胞从肠道开始迁移,经过脂肪组织,最终进入脑部。相反,在无菌环境下生长的小鼠体内,脑中几乎观察不到T细胞,证明肠道微生物群对T细胞迁移路径有直接影响。同时,研究人员还发现,缺少脑内T细胞的小鼠在经历短暂禁食后表现出异常的食物摄取行为,暗示这些免疫细胞在调节食欲和代谢行为方面或起着关键作用。肠-脂肪-脑轴因此被提出,作为解释T细胞如何从消化系统迁徙至大脑的全新模型。
与已知的肠脑轴通讯方式——如迷走神经传导和血液中小分子信号物质不同,免疫细胞携带更为复杂和精准的信息,用于实时反馈肠道健康状态与整体能量平衡。这种细胞层面的信息传递,既突破了传统分子扩散的局限,又为人体内脏器官间的交流打开了全新视角。来自耶鲁的主导学者表示,设计上这种方式极具“智慧”:通过重新编程免疫细胞,让它们成为反映肠道状态的活体传感器,亲自“向大脑汇报”关键信息,促进大脑对生理变化的快速响应和调整。脂肪组织在这一通路中扮演“质控站”的角色,可能为T细胞提供再加工或筛选,确保携带信息的准确性和有效性。虽然脂肪组织在代谢调控和内分泌信号中早被广泛研究,但其作为免疫细胞迁移中转站的功能则为人所罕见,开拓了免疫与代谢交叉点的研究新方向。当前的研究还聚焦于理解T细胞如何接收到从肠道发出的迁移指令,下游信号如何使其精准定位于大脑特定区域,未来也将探讨这些健康状态下的脑内T细胞在神经退行性疾病中的表现及潜在影响,如多发性硬化症和帕金森病。
T细胞的发现对于大脑免疫调节机制的认识产生深远影响。它不仅说明大脑对外部免疫细胞的屏蔽并非完全,而是存在选择性的交流渠道,还揭示了免疫系统与神经系统之间远比以往想象的复杂和精细。这种免疫细胞跨越脏腑边界,参与调节生物节律、行为和代谢的能力,为未来设计针对神经免疫疾病的新疗法提供了契机。除此之外,肠道菌群作为整个肠-脂肪-脑轴的启动端,对维持神经和免疫平衡的作用更加被重视。微生态环境的健康直接影响T细胞状态和迁移,这提示饮食、益生菌干预及肠道健康管理有望借由调节T细胞行为间接促进神经健康。耶鲁医学院的这项研究成果不仅发表在权威期刊Nature,受到了国内外神经免疫领域专家的广泛关注和积极评价。
它体现了多学科交叉整合创新研究的典范,融合了神经科学、免疫学、微生物学和内分泌学的最新进展。展望未来,学界期待通过更深入的细胞追踪技术、基因表达分析及临床样本研究,全面揭示T细胞在脑内的多重角色,阐明肠-脂肪-脑轴如何影响大脑功能和人体健康。此项发现提醒我们,人体各个系统之间的联系远比表面直观的解剖结构复杂,每一条信息传递通路都可能隐藏着关键的生理调控密码。正是这些不断被揭开的秘密,推动医学进入一个更加精准和个体化诊疗的新时代。随着对肠-脂肪-脑轴的理解日益深入,未来不仅有望开发出针对神经系统疾病的新型免疫治疗策略,还可能促进健康老龄化、提高生活质量,为公众健康带来切实益处。