克雷布斯循环,也被称为柠檬酸循环或三羧酸循环(TCA循环),是所有需氧生物体内释放能量的关键代谢路径。它通过氧化乙酰辅酶A(acetyl-CoA),实现营养物质中储藏能量的释放,最终为细胞生物合成和能量储备提供必要的分子基础。克雷布斯循环不仅在动植物细胞中发生,还广泛存在于绝大多数需氧微生物,是支撑生命新陈代谢的核心环节之一。其发现与发展经历了近一个世纪的科学探索,体现了生物化学研究的重要进步。 克雷布斯循环于1937年由汉斯·阿道夫·克雷布斯(Hans Adolf Krebs)和威廉·亚瑟·约翰逊(William Arthur Johnson)在英国谢菲尔德大学首次明确描述,克雷布斯因此获得1953年诺贝尔生理学或医学奖。早在此之前,匈牙利生物化学家圣捷尔吉·阿尔伯特(Albert Szent-Györgyi)因研究其中的富马酸而获得了1937年诺贝尔奖。
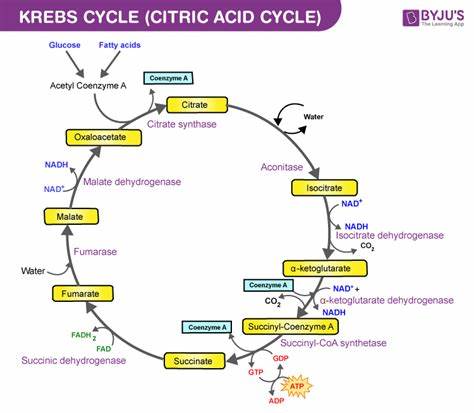
克雷布斯循环的发现揭示了细胞依赖氧化分解碳水化合物、脂肪和蛋白质实现能量释放的秘密,为生物能量代谢的现代理解奠定了基础。 克雷布斯循环本质上是一个将乙酰辅酶A与草酰乙酸(oxaloacetate)结合形成柠檬酸的循环反应过程。柠檬酸随后经历多步转化,产生二氧化碳、还原态辅酶(NADH和FADH2)和高能化合物如GTP或ATP。每一轮循环都消耗一分子乙酰辅酶A并再生草酰乙酸,完成循环。NADH和FADH2随即进入电子传递链,驱动细胞内氧化磷酸化反应,合成大量ATP,满足细胞的能量需求。 克雷布斯循环通过八种酶催化完成关键的生化反应。
起始于乙酰辅酶A与草酰乙酸结合生成柠檬酸,经过异构化为异柠檬酸,随后通过异柠檬酸脱氢酶催化氧化脱羧产生α-酮戊二酸(α-ketoglutarate)和二氧化碳。在此过程中伴随着NAD+被还原成NADH。接着,α-酮戊二酸脱氢酶复合体催化其脱羧生成琥珀酰辅酶A,同时释放二氧化碳和还原NAD+。琥珀酰辅酶A转化为琥珀酸,伴随GDP磷酸化生成GTP或ADP产生ATP。琥珀酸脱氢酶随后氧化琥珀酸为延胡索酸,FAD被还原为FADH2。延胡索酸水合形成苹果酸,苹果酸被氧化还原为草酰乙酸,NAD+被还原,完成循环。
克雷布斯循环产物主要包括碳排放形式的二氧化碳、还原性辅酶NADH和FADH2以及能量分子GTP或ATP。每分子乙酰辅酶A参与一次循环,释放三分子NADH、一分子FADH2及一分子GTP/ATP,同时释放两分子二氧化碳。氧化磷酸化阶段,NADH和FADH2作为电子供体产生大量ATP,整合完成能量的高效转换。值得注意的是,一分子葡萄糖经过糖酵解形成两个丙酮酸,分别转换成两分子乙酰辅酶A,故整个能量代谢过程涉及两轮克雷布斯循环。 克雷布斯循环的高能效率来源于其复杂的氧化还原反应复合网络。在理想条件下,一分子葡萄糖通过糖酵解、丙酮酸脱羧和克雷布斯循环最终可产生约30至38分子ATP。
由于实际生理条件中存在质子泄漏等能量损失,最终净产量通常为30个ATP左右。循环过程不仅释放能量,也为细胞提供多种生物合成所需的重要中间体。克雷布斯循环因此被称为桥梁,连接碳水化合物、脂肪和蛋白质代谢。 克雷布斯循环的调控是细胞能量代谢的关键环节,涉及多种酶的活性调控和底物及产物反馈。关键酶如柠檬酸合酶、异柠檬酸脱氢酶及α-酮戊二酸脱氢酶受NADH、ATP和其底物的浓度变化调节。当细胞内ATP充足时,这些酶的活性降低,防止能量过度耗费。
相反,当ADP或Ca2+浓度升高时,这些酶被激活,加速循环以满足能量需求。此类复杂的酶促调控机制保障了细胞代谢的灵活性与高效性。 除了经典的真核生物克雷布斯循环,细菌和其他微生物中也存在多种循环变体。这些变体适应了不同环境条件,如缺氧或特殊底物,展现出代谢多样性。例如某些细菌中异柠檬酸脱氢酶使用NADP+替代NAD+,而琥珀酰辅酶A合酶亦存在不同的亚型。还有的微生物通过替代途径绕过循环中的某些步骤,以适应低氧或其他极端环境。
这些生物学变异揭示了克雷布斯循环的进化适应性。 克雷布斯循环在癌症代谢中扮演重要角色。肿瘤细胞通常表现为代谢重编程,其中特殊代谢产物如2-羟基戊二酸(2-hydroxyglutarate)在异柠檬酸脱氢酶(IDH)突变细胞中积累,形成所谓"致癌代谢物"。这些代谢物通过抑制α-酮戊二酸依赖性酶类,影响基因表达和细胞表型,促进肿瘤生长。此类代谢变化反映了克雷布斯循环衍生代谢产物在调控细胞命运中的复杂影响。 克雷布斯循环不仅在能量代谢中意义深远,它所产生的中间代谢物还是多种生物合成反应的重要前体。
柠檬酸可被转运至胞质作为脂肪酸和胆固醇等脂类合成的乙酰辅酶A来源。草酰乙酸和α-酮戊二酸参与氨基酸和核苷酸生物合成。琥珀酰辅酶A则是血红素前体合成的关键底物。多种氨基酸通过脱氨作用转变为循环中间体,表现出克雷布斯循环对氨基酸代谢的整合性。 克雷布斯循环的进化历史悠久且复杂。科学家推测其起源与古代需氧细菌相关,早期生命可能通过类似循环完成能量代谢并逐步演化。
甚至有研究表明部分克雷布斯循环反应在无酶条件下亦可自发发生,提示其可能先于生命本身。虽然多个替代循环在自然界存在,但克雷布斯循环因其高效性与化学稳定性被大多数生物所采用,反映了生物代谢系统优化的天然结果。 当前,随着分子生物学和代谢组学技术的进步,克雷布斯循环的研究更趋精细和多元。科学家不断揭示其在细胞应激响应、信号传导和疾病发生中的新功能。特别是在代谢性疾病、肿瘤以及免疫细胞能量代谢调控中的作用,克雷布斯循环正成为生物医学研究和药物开发的前沿热点之一。 克雷布斯循环作为生命能量转换的关键枢纽,不仅支持细胞的基本代谢需求,也桥接了生物大分子的合成与分解,赋予细胞高度的代谢灵活性和适应性。
了解其机制和调控对揭示生命活动本质、应对疾病挑战具有重要指导意义。未来围绕克雷布斯循环的研究将持续推动生物科学和医学领域的发展,为精准医疗和代谢工程提供坚实的科学基础。 。