视网膜疾病如视网膜色素变性和青光眼等导致视力损伤和丧失的发病率逐年上升,严重影响了患者的生活质量。传统的治疗手段多为缓解症状或延缓病程,无法逆转已损坏的视网膜细胞。因此,科学家们一直寻求能够促进视网膜细胞再生成效的治疗方案。Müller胶质细胞是一种遍布视网膜全层的星形胶质细胞,近年来被证实不只是结构和支持的提供者,更具备一定的神经再生潜力。尤其是在某些非哺乳动物如斑马鱼中,Müller胶质细胞可以通过转化为视网膜祖细胞,进而分化为新的神经细胞,实现视网膜的再生和修复。然而,这种能力在人类及其他哺乳动物中表现的非常有限,这成为制约视网膜再生治疗发展的关键障碍。
核心的研究发现之一是Prospero相关同源盒基因1(Prox1)在Müller胶质细胞中的作用。Prox1是一种高度保守的转录因子,既影响发育过程中的神经细胞分化,也在维持细胞的细胞周期状态中发挥重要作用。最新的研究表明,Prox1在退化的哺乳动物视网膜中的Müller胶质细胞中异常积累,这种积累并非由Müller胶质细胞自身产生,而是通过邻近的视网膜神经元向其转移。该机制被认为是限制Müller胶质细胞重新编程成视网膜祖细胞,进而阻碍视网膜自我修复的重要因素。 采用多种视网膜损伤模型,包括化学诱导的视网膜光感受器退化和遗传性视网膜色素变性模型,研究中发现阻断对Prox1的转移能够显著激活Müller胶质细胞的增殖活性,使其重新进入细胞周期,表现出类似视网膜祖细胞的特征。这一突破性发现对于理解视网膜再生障碍机制具有重大意义,同时也为开发基于Prox1阻断的新型基因或蛋白质疗法打下基础。
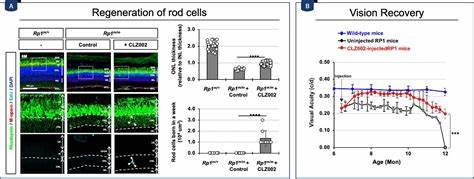
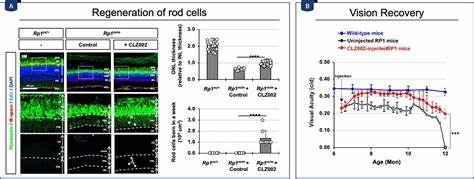
研究团队利用腺相关病毒(AAV)载体表达针对Prox1的单链抗体(scFv),成功将该抗体分泌至视网膜细胞间隙,有效抑制了Prox1传递,促进了损伤视网膜中Müller胶质细胞的再生反应,并在视网膜色素变性模型小鼠中延缓了视觉功能的丧失。 尽管阻断Prox1传递显著提升了哺乳动物Müller胶质细胞的再生能力,但其增殖和分化效率仍低于斑马鱼等冷血动物。这提示其他分子通路和外界信号同样参与调控Müller胶质细胞的活化和再生过程。例如,Wnt、Notch和Shh等信号通路在斑马鱼视网膜再生中扮演关键角色,而这些通路在人类视网膜中调控复杂,且存在多个抑制性因子。此外,表观遗传调控也被证实对Müller胶质细胞的再生潜力具有深远影响。研究显示,激活或抑制特定的组蛋白修饰酶和DNA甲基化酶,可改善相关神经发生基因的表达,从而配合Prox1的阻断,实现更佳的再生效果。
深入剖析Prox1转移的机制发现,Müller胶质细胞借助胞外基质中的硫酸软骨素和硫酸肝素等糖胺聚糖组分选择性地捕获来自邻近神经元的Prox1分子,使其在细胞内积累,进而发挥抑制细胞周期重新激活的作用。这种选择性蛋白转移为视网膜细胞间通讯机制提供了全新视角,类似于在大脑皮层中观察到的Otx2转录因子转移现象,从而揭示了膜结合糖胺聚糖作为蛋白质传播调控关键因子的广泛功能。 在临床角度,鉴于Prox1在退化人类视网膜中的累积现象,针对Prox1的抑制策略具有较强的转化前景。早期的动物实验表明,早期介入阻断Prox1传递不仅能够恢复一定程度视网膜结构,还能在一定时间窗口内恢复视觉功能。这为早期诊断和治疗视网膜疾病提供了理论依据和新策略。同时,如何实现长期稳定的抗体表达和Prox1水平的调控,将是未来开发临床应用关键所在。
视网膜再生领域的最新进展表明,单一抑制或激活路径虽能激发部分再生潜能,但多路径联控、多因素综合干预才是实现全面且有效视网膜修复的理想方案。结合Prox1阻断策略与Notch信号通路调控、转录因子Ascl1的适时表达,以及促进表观遗传开放状态的分子工具,将可能实现对哺乳动物视网膜再生能力的显著提升。 未来研究需着重解决Müller胶质细胞再生潜能的激活机制,深入理解Prox1与其他信号通路的交互作用,同时优化病毒载体和抗体设计,实现持续高效的蛋白质干预。此外,如何诱导再生细胞精准分化成视网膜的多种功能神经细胞,增强新生神经元的整合能力,也是治疗视网膜退行性疾病成功的关键。多学科协作和新技术手段,如单细胞测序、高分辨成像和基因编辑技术,将加速这些目标的实现。 在视网膜退化疾病患者中恢复视力,不仅仅是科学上的突破,更承载着社会和家庭的巨大期望。
Müller胶质细胞作为视网膜内潜藏的再生"种子",其潜能的释放或将改写视网膜损伤治疗的历史,为数以百万计患者带来希望。当前的突破揭示了Prox1作为核心抑制因子的关键角色,未来结合多靶点策略必将推动视网膜再生医学进入崭新的时代。 。