视网膜退行性疾病,如视网膜色素变性和青光眼,因视网膜细胞的不可逆损伤导致视力逐渐丧失,严重影响患者生活质量。不同于变温脊椎动物如鱼类和两栖类在神经系统损伤后能够激活自身再生能力,哺乳动物的中枢神经系统(CNS)则表现出极其有限的自我修复能力,视网膜尤其如此。然而,Müller胶质细胞(MG)作为视网膜中特有的胶质支持细胞,在鱼类具有重要的视网膜再生作用,能够在受伤后通过去分化转变为视网膜祖细胞(RPCs),并进而分化为多种神经元类型,参与视网膜修复。这一发现激发了科学界寻求激活哺乳动物MG的再生潜力,以替代或修复失去的视网膜神经元的研究热潮。近期,一项发表于《自然通讯》的开创性研究揭示了哺乳动物MG再生能力受限的关键障碍因素,与未来的视网膜再生治疗紧密相关。研究指出,Prospero相关同源盒转录因子1(Prox1)在哺乳动物MG中通过一种新的细胞间转移机制积累,成为抑制MG重编程的主要"刹车"。
该机制揭示了新的治疗靶点,为破除哺乳动物视网膜再生瓶颈提供了关键突破。Prox1蛋白通常稳定表达于视网膜内的神经元群体,如水平细胞、双极细胞和部分无长突细胞亚群,调控神经发育中的细胞周期退出和分化方向。然而,令人意外的是,受损后的哺乳动物视网膜中MG细胞也呈现出Prox1蛋白的异常积累,并且这一现象并非因MG内源性表达增加而引发,而是通过邻近神经元向MG的跨细胞蛋白转移实现。该跨界转移机制是多种同源盒家族蛋白的典型特征,首次在视网膜MG中被发现并证实。研究团队通过特定基因敲除技术,选择性地剔除双极细胞中的Prox1表达,结果显著降低了MG细胞内Prox1水平,成功激活MG的增殖潜能。进一步通过单细胞RNA测序证实,Prox1减少使得MG得以去分化为RPC样细胞,这些细胞不仅进入细胞周期,还激活了与再生相关的多种调控途径,如Notch1信号和促增生因子Ccnd1的上调,表明这一过程不依赖于传统的神经干细胞转录因子Ascl1,而是存在替代的调控机制。
为了验证细胞外Prox1的功能,研究者设计了特异性抗Prox1单链抗体(αProx1),通过腺相关病毒载体介导持续表达,有效阻断了Prox1在视网膜内的细胞间转移。αProx1治疗显著减低MG积累的Prox1,促进了MG向RPC的重编程,并且在小鼠视网膜损伤模型中观察到新生视网膜神经元的出现,延缓了视网膜色素变性模型中视力损失的进程,这一创举标志着MG介导的视网膜神经再生治疗走向临床应用铺筑了坚实的基础。对比于具有自然再生能力的斑马鱼,哺乳动物MG的这一潜能被Prox1有效抑制。实验证实向斑马鱼视网膜内注入重组Prox1蛋白会显著抑制MG的增殖和再生过程,这进一步印证Prox1在跨物种视网膜再生调控中的核心抑制角色。与此同时,斑马鱼损伤后MG内Prox1水平未见明显上升,显示了MG自我保护机制的生物学差异。分子机理上,Prox1可直接或通过调控Notch-Hes1信号抑制关键神经营养因子的表达,同时降低细胞周期关键蛋白如Ccnd1和Cdk4的活性,阻止MG细胞再次进入增殖阶段。
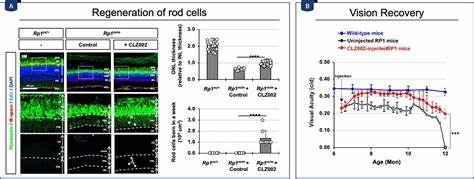
此外,Prox1被认为诱导MG表达多种细胞外基质成分,如糖胺聚糖,可能增强MG对外源Prox1蛋白的捕获能力,形成负反馈调控环路。该研究还揭示了MG通过捕捉邻近神经元在视网膜层间隙释放的Prox1,形成局部高浓度抑制信号,维持视网膜稳态,避免异常增殖。从临床视角看,阻断Prox1转移的策略为视网膜退行性疾病开辟了新兴治疗道路。视网膜色素变性早发性鼠模型(Pde6brd10/rd10)和晚发性Rp1m/m模型中,腺相关病毒介导的αProx1治疗明显促进新生杆状光感受器的产生,恢复视网膜结构的层次完整性,改善视网膜电生理功能和视觉敏锐度。值得关注的是,该治疗在疾病进展早期进行效果最佳,且恢复效果因视网膜病理环境及分子激活状态的不同呈现时效性,提示未来需结合更长效的表达载体和多靶点联合策略。视网膜MG的再生潜力恢复不仅关乎单一基因的调控,更涉及复杂的信号网络和细胞微环境。
除了Prox1之外,Notch信号途径的动态调节、Yap/TAZ的激活以及表观遗传重塑等因素均是确保MG完全转化为功能性RPC及其后代神经元的关键环节。科学家推测,Prox1阻断或许是启动这一路径的"钥匙",而后续激活步骤则可能需要辅以其他信号干预,如Notch抑制剂、Wnt激活剂及细胞周期调控因子,才能实现实质性的视网膜神经再生与功能恢复。未来,针对Prox1转移的分子机制研究仍具挑战,尤其是MG对Prox1蛋白的选择性捕获机制尚未完全阐明。与斑马鱼相比,哺乳动物MG与视网膜神经元间的糖胺聚糖代谢差异可能决定了这一转移过程的效率和特异性。深入剖析这些细节将有助于开发更精准的治疗分子和递送技术。随着基因编辑、病毒载体和蛋白工程技术的快速进步,结合临床眼科用药递送体系,基于αProx1的视网膜再生治疗极有可能在未来成为现实,为视网膜退行性疾病患者带来真正的疗效。
综上所述,Müller胶质细胞的再生潜能受控于邻近神经元通过Prox1的细胞间转移机制,阻断该通路能够释放MG的"制动",恢复其重编程为RPC并再生神经元的能力。这一发现不仅深化了我们对视网膜再生机制的理解,而且指明了新型治疗方向,推动视网膜神经损伤疾病走向治疗新纪元。未来的研究应着力优化抗Prox1治疗策略,联合多信号通路调控,实现更高效、更持久的视网膜再生效果,造福广大视力障碍患者。 。