小细胞肺癌(Small Cell Lung Cancer,简称SCLC)是一种极具侵袭性的肺癌类型,约占肺癌病例的15%。其特点是细胞快速增殖、早期广泛转移、高复发率以及总体生存期极短。传统治疗手段包括铂类化疗联合依托泊苷,以及免疫检查点抑制剂加选用性预防性脑照射,尽管初始反应率超过六成,但治疗效果多为短暂,患者中位生存期约为一年。过去,SCLC的研究集中在其分子遗传背景和肿瘤细胞的内在特性上,而神经系统与肿瘤的互动机制尚未被充分认识。近年研究表明,肿瘤微环境中的神经支配对癌症的发生和发展具有重要作用。尤其是在神经胶质瘤等中枢神经系统肿瘤中发现,肿瘤细胞能够形成直接的、功能性的突触与神经元相连,促进肿瘤的增殖及侵袭。
但是,外周肿瘤中是否存在类似的神经-肿瘤突触尚存疑问。最新研究突破这一认识盲点,揭示了SCLC细胞拥有形成功能性神经突触并从中获益的能力。科学家采用小鼠模型和人类肿瘤样本,通过插入突变、跨物种基因组和转录组学验证,锁定了多个与神经突触形成及谷氨酸信号传导相关的基因集。这些基因不仅在小鼠SCLC中富集,也在452例人类样本中显著突变例如NRXN1(突触神经元连接蛋白)、NLGN1(神经胶质细胞连接蛋白1)、DCC(引导神经元生长的受体)与RELN(指导神经迁移蛋白)基因。这一发现说明神经信号相关的基因在SCLC肿瘤发生过程中具有潜在促进作用。实验层面显示,无论是在体内还是体外培养中,SCLC细胞能与神经元形成结构完整的突触结构。
电生理学检测及光遗传学实验进一步验证了这类突触能够实现NMDA受体和GABAA受体介导的神经传递。功能意义上,SCLC细胞在与迷走神经类感受器或大脑皮质神经元共培养时,表现出显著的增殖优势,提示神经元输入对肿瘤细胞增殖具有推动效应。尤其,谷氨酸受体信号通路在此过程中扮演关键角色,且通过靶向阻断谷氨酸信号途径的药物在SCLC小鼠模型中表现出抑制肿瘤生长的疗效。综上所述,SCLC细胞似乎通过劫持神经突触信号,促进其恶性增殖,为临床干预提供新方向。SCLC起源于肺部的神经内分泌细胞,这类细胞本身就具有表达神经元特定标志基因的能力,能够伸展突起,并在正常生理状态下受到来自结节、颈静脉球以及背根神经节的神经纤维支配。SCLC中可以根据其分子特征分为ASCL1驱动的SCLC-A、NEUROD1驱动的SCLC-N、POU2F3驱动的SCLC-P以及炎症型或YAP1表达型SCLC-I或SCLC-Y。
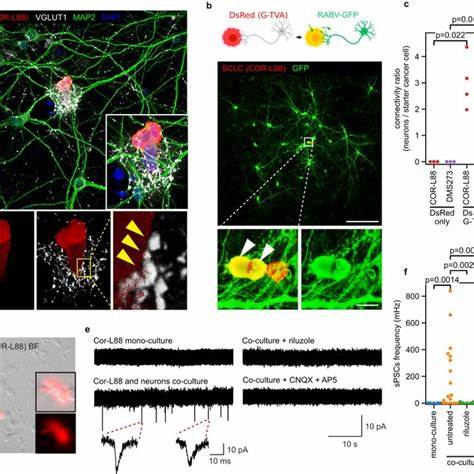
其中SCLC-A及SCLC-N亚型表现出可发放动作电位的神经元样电活动特征。这一点暗示其神经元类表型及功能。深入调查发现,神经内分泌细胞周边存在丰富的Vesicular Glutamate Transporter 1(VGluT1)、P2X3和GAP43阳性神经纤维,这些神经纤维能够进入早期及中小型SCLC肿瘤体内,并形成与癌细胞之间的密切接触。大型肿瘤中神经纤维通常局限于边缘区,细胞内部神经纤维较少。这种结构类似于神经胶质瘤内神经元与肿瘤细胞形成的突触形态,表明肿瘤细胞具有接受神经调控的潜能。共培养实验中,人类SCLC细胞与啮齿类皮层神经元共培养,免疫标记验证了神经轴突末端的谷氨酸囊泡蛋白VGluT1与肿瘤细胞的HOMER1(突触后密度蛋白)呈高度共定位,显示研究中的突触标志形成。
超分辨率显微技术,如STED及扩增显微术,揭示了神经末梢和肿瘤细胞之间预-后突触蛋白的空间精密排列,峰间距离与正常神经元间的突触匹配。电镜及对应光-电镜协同技术进一步鉴定了具有典型结构的突触小体、囊泡池及突触间隙的形成。功能检测方面,在SCLC与神经元的共培养中,肿瘤细胞表现出由神经元活动驱动的自发突触后电流,药理学阻断NMDA受体或AMPA受体、或使用阻断钠通道的特丁匹林均能显著抑制这一电活动。这证明SCLC细胞能够快速响应神经元释放的谷氨酸信息并介导电生理学反应。光遗传刺激进一步实证了神经元激发对肿瘤细胞电流的诱发效应,并且这一效应被NMDA受体阻断剂抑制。利用蒙藏性缺失G基因的狂犬病病毒单突触逆行追踪技术,研究团队发现SCLC细胞能够与神经元形成功能性连接,连接神经元主要为兴奋性谷氨酸能神经元,同时也存在抑制性GABA能神经元的连接。
这些神经连接增加了肿瘤细胞对外界神经信号的感知力和响应,为肿瘤增殖及进展提供驱动力。神经元对SCLC细胞的增殖促进作用显著,无论不同分子亚型的SCLC细胞均能从神经元共培养中获得生长优势。该优势不仅依赖神经兴奋性传导,还可能包括神经元分泌的非神经传递物质影响。此发现提示肿瘤-神经元互作机制的复杂性及多层次调控。进一步,研究者针对谷氨酸信号通路进行了药物干预。G蛋白偶联型谷氨酸受体8型(GRM8)是一种在SCLC中高表达并与肿瘤细胞亚型相关的受体,具有调节谷氨酸信号的抑制作用。
通过激动剂DCPG和谷氨酸释放抑制剂利鲁唑在SCLC小鼠模型中测试治疗效果,显示两者均可延缓肿瘤进展,延长小鼠生存期。利鲁唑在联合标准化疗方案中的表现尤其出色,显著提高了治疗反应率,提示抑制谷氨酸介导的神经突触信号是一种极具潜力的治疗策略。该研究首次证明外周来源恶性肿瘤 - - SCLC能够与神经元形成功能性化学突触,实现神经信号的直接传递,促进肿瘤的增殖。它揭示了肿瘤神经系统相互作用在肺癌中的新机制,也证实了肿瘤细胞对神经信号的"劫持"现象。神经元对肿瘤的支持作用不仅体现在神经元本身的电活动,还可能通过释放的神经营养因子、神经肽等多种物质影响肿瘤微环境,促进肿瘤细胞的生存与迁移。未来研究需进一步探讨这些交互作用在肺部原位肿瘤微环境中的具体功能及其在肿瘤免疫逃逸和转移中的角色。
随着对肿瘤神经交互网络深度理解的建立,针对神经肿瘤突触的分子剂靶向治疗将打开个性化治疗新篇章,如结合谷氨酸信号抑制剂、神经元电活动调节剂等,配合传统放化疗和免疫治疗,提高小细胞肺癌患者的总体生存质量。目前,小细胞肺癌患者面临的治疗困境亟待打破,相关研究提供了前瞻性疗法探索的科学基础。神经元与小细胞肺癌间形成功能性突触的发现,代表癌症生物学与神经科学的交叉创新,标志着肿瘤微环境研究进入了一个崭新的维度。未来,我们期待更多研究能够深入揭示神经调控肿瘤发展的分子机制,推动形成多模态的癌症综合治疗方案。总之,SCLC与神经元的功能性突触不仅为侵袭性肺癌的发病机制提供了新见解,同时也提出了创新治疗策略的巨大潜能,预示着肿瘤神经学领域的下一个突破。 。