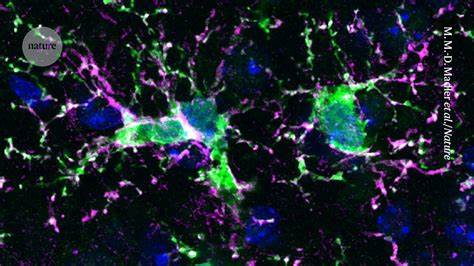
什么是小胶质细胞,它们为什么重要 小胶质细胞是中枢神经系统中主要的免疫细胞,起源于胚胎时期的卵黄囊巨噬细胞,终生驻留于脑组织。它们负责清理细胞碎片、吞噬有害蛋白沉积、修剪突触、支持神经发育与再生,以及感知并响应病理信号。正常状态下,小胶质细胞维持脑内环境稳态;但在衰老和多种神经退行性疾病中,小胶质细胞会表现出持续激活或功能失调,产生过量炎症因子、减少清除有害聚集蛋白的能力,反而促进疾病进展。这一"失控"的免疫反应被认为是阿尔茨海默病、帕金森病、多发性硬化以及多种罕见遗传性脑病的重要推动因素之一。 为什么考虑"替换"而不是"抑制"或"激活" 小胶质细胞的多样性和可塑性使得单纯抑制或长期激活并非最佳策略。某些情境下抑制炎症短期有效,但长期可能削弱神经保护功能;反复激活也可能加速神经损伤。
替换策略的思路是先清除或减少功能异常的"老化"或"病理化"小胶质细胞,然后引入或诱导更健康、功能正常的替代细胞。这样可以在微环境允许的情况下重建更平衡的免疫状态,恢复有效的吞噬和修复能力,为进一步的再生或药物干预创造条件。 小胶质细胞替换的技术途径 有几类技术在动物研究和部分临床试验中被探索。其核心步骤通常包含先"清扫"原有小胶质细胞,然后"移植"或"诱导"新的细胞来源。 清除小胶质细胞:CSF1R抑制剂是目前最常见的工具之一。CSF1R(集落刺激因子1受体)对于小胶质细胞生存至关重要,使用口服小分子抑制剂可以在数天至数周内大幅减少脑内小胶质细胞数量,为后续植入或自然替代创造空位。
放疗或化学去髓鞘处理结合造血干细胞移植的方法也被用于促进外周来源细胞进入脑组织并占位。 替代细胞的来源:外周造血干细胞或骨髓移植常被用来提供来源,特别是在一些遗传性脑病中,供体来源的微卫星细胞或单核细胞能在特定条件下进入中枢并分化为类似小胶质细胞的细胞。诱导多能干细胞(iPSC)或胚胎干细胞则可以体外分化为微胶质样细胞,经过基因修饰后再移植,以便补偿遗传缺陷或增强特定功能。基于基因编辑的造血祖细胞治疗将供体细胞修改为携带治疗性基因,然后回输给患者,以实现长期替换与持续分泌有益分子。 局部注射与系统输注:将细胞直接注入脑室或脑实质可以实现高局部浓度,但侵入性强,风险较高。静脉或腰穿后注入结合暂时开放血脑屏障或先用CSF1R抑制剂消耗内源小胶质细胞也能促进外周细胞进入脑组织与占位。
研究证据与潜在疗效 在多种小鼠模型中,替换小胶质细胞显示出多种潜在益处。在一些阿尔茨海默病模型中,替换后新的细胞更有效地吞噬淀粉样蛋白,减少淀粉样斑块负担,降低神经炎症标志物,改善认知表现。在罕见的遗传性白质或溶酶体贮积病模型中,供体来源的免疫细胞移植能部分替代功能缺陷的宿主细胞,减缓疾病进展并改善神经功能。骨髓移植或造血干细胞移植在某些儿童遗传性脑病(如与髓鞘缺陷相关的病症)已有成熟的临床应用案例,提示通过外周干细胞影响中枢免疫具有可行性。 需要强调的是,不同疾病、不同模型、不同替换策略的结果差异很大。成功的关键因素包括移植细胞的来源与质量、宿主脑内微环境、消耗内源小胶质细胞的方法、移植时机以及是否联合其他治疗。
风险、界限与尚未解决的问题 尽管替换小胶质细胞看起来有吸引力,但仍存在重大风险和基础科学挑战。微环境影响与功能同化:胚胎来源的小胶质细胞与外周单核细胞来源的"微胶质样"细胞在基因表达谱与功能上并不完全相同。即使移植后新细胞能占位,它们是否能长期获得与原生小胶质细胞相同的功能与调控仍不确定。免疫排斥与炎症反应:异体细胞移植可能引发免疫反应或胶质瘢痕,反而加重病理。即便是自体细胞,基因编辑后也可能出现新的免疫原性。长期安全性与肿瘤风险:干细胞来源的细胞移植需谨慎评估潜在的异常增殖或肿瘤形成风险。
方法学与可控性:CSF1R抑制剂虽能高效去除小胶质细胞,但这一过程也会暂时削弱脑内免疫监视,可能增加感染或其他并发症风险。移植后临床效果的测量标准缺乏统一的生物标志物,需要更精细的影像学、脑脊液与功能评估工具。 哪些病种可能首先受益 从临床可行性和伦理考虑出发,那些已经证明对造血干细胞移植敏感的遗传性脑病可能率先受益。对于单基因缺陷导致的代谢病或白质疾病,通过替换携带功能性基因的免疫细胞来持续提供缺失酶或修复缺陷具备直接机制学基础。阿尔茨海默病与帕金森病等复杂退行性疾病的患者群体更大,但病因复杂且多因素交互,替换小胶质细胞能否在临床上带来长期且可观的认知改善仍需大规模临床试验验证。 监管、伦理与患者选择的考量 替换小胶质细胞的治疗通常涉及高风险的细胞或基因治疗,监管路径严格。
临床试验需要合理设计患者选择标准、分层策略与长期随访方案。对于儿童罕见病,早期移植可能带来更好效果,但也要慎重权衡潜在长期不良事件。对自体与异体策略的伦理讨论、对知情同意过程的强化以及透明的风险沟通都是不可或缺的。 面向未来的研究方向 与其将"替换"视为单一手段,更有前景的策略可能是将细胞替换与其他治疗联合起来。例如,替换后的细胞可以被基因工程为持续分泌抗炎或神经保护因子,与抗β淀粉样蛋白抗体、小分子抑制剂或神经再生疗法协同工作。更精细的单细胞测序和空间组学将帮助理解不同脑区小胶质细胞的差异,以便开发更针对性的替换策略。
非侵入性的影像学与液体活检方法将是评估疗效與安全的重要工具。 精准医疗與个性化治疗的潜力 每个患者的疾病进展路径、基因背景、免疫状态及脑内微环境都有差异。未来替换策略可能走向个性化设计:基于患者自身iPSC生成个体化的微胶质样细胞,结合基因编辑修正病变基因,并在最优时间窗口内回输,以达到长期受控的替换与治疗效果。 结语 把"换血"式的概念应用到脑内免疫系统,是近年来神经免疫学领域的一个创新方向。理论上,通过去除功能异常的小胶质细胞并引入更健康的替代细胞,可以减轻有害炎症、增强有利的吞噬清除功能,并在一定条件下改善神经功能。然而,这一策略从动物模型走向临床仍面临诸多科学与伦理挑战,需要更多严谨的长期研究、优化的工程细胞来源、细致的安全评估与透明的监管框架。
对于特定的遗传性脑病与部分神经退行性疾病,这一方向有望成为补充或替代现有疗法的重要途径,但实现广泛临床应用还需时间与耐心。 。