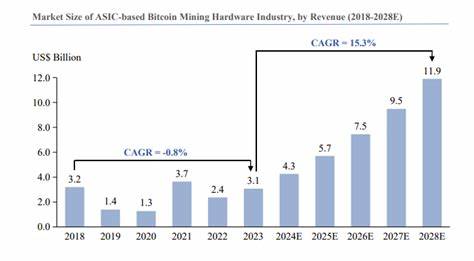
近年来,生物技术领域迎来了重大突破,特别是在酶的设计与合成方面。利用计算机算法结合物理学知识,科学家成功打造出一类效率远超传统人工设计的合成酶。这些新型酶不仅催化速度极快,而且能够催化自然界中未曾发现的化学反应,极大地拓宽了生物催化的应用范围。合成酶是研究生命科学、医药开发和环保产业的重要工具。传统酶的发现和优化依赖于反复的实验筛选和改良,过程复杂且耗时。随着计算机科学和人工智能的发展,基于机器学习的蛋白质设计已经取得了显著进展,但仍然存在合成效率和实际应用效果不足的问题。
近期发表在顶尖科学期刊Nature上的研究表明,一种结合物理知识的算法设计方法,在构建高效合成酶方面取得了突破性进展。该方法基于分子动力学和量子力学原理,从物理层面解析酶与底物的相互作用,并通过计算模拟优化催化中心和蛋白质构象。这不仅大幅提高了设计的准确性,还减少了实验调试的次数,实现了酶功能的快速实现。令人瞩目的是,这些合成酶催化的反应类型在自然界中未曾出现,显示出前所未有的催化能力。实验结果显示,新酶的催化速率和效率与自然酶相当,甚至在某些反应中超过了天然酶近100倍。这种酶设计的成功不仅为理解酶催化机制提供了新视角,也为生物催化剂的工业大规模应用奠定了基础。
新合成酶的应用潜力极其广泛。它们能够催化复杂的化学转换,有望在制药、绿色化学、农药生产和环境修复等领域发挥重大作用。例如,在药物合成过程中,这些酶可以有效提高合成路线的选择性和产率,减少对有害化学试剂的依赖,从而推动药物产业向更环保、更高效方向发展。此外,合成酶在生物燃料生产及废弃物降解中的应用也表现出巨大潜力,有助于实现可持续发展的目标。设计新酶的核心在于对酶结构和功能的深刻理解。传统AI蛋白质设计依赖大量数据驱动,容易陷入局部最优解,限制了创新能力。
而引入物理学原理的算法,则通过模拟真实的分子运动和能量变化,能够准确预测蛋白质折叠及其催化机制。这种物理驱动的设计策略使得合成酶的活性位点高度精准,催化效率显著提升。该技术的发展背后离不开跨学科团队的紧密合作。化学家、生物学家、物理学家和计算科学家的协同努力,加速了实验验证与计算模型的相互反馈。在实验室中,合成酶经过多轮迭代优化,每一次新设计均基于对既往失败案例的深入分析。这样的循环过程,使得合成酶不断完善,其性能不断突破先前极限。
尽管取得巨大成功,但新合成酶设计依然面临挑战。包括如何进一步提高酶的稳定性,使其在工业复杂环境中长期运行而不失效;如何降低设计成本,实现大规模商业化生产;以及如何准确预测酶催化多种不同底物的能力等问题,都是未来研发的重要方向。同时,数据隐私与伦理问题也引发关注。随着算法在分子设计中的广泛应用,相关数据的安全管理成为重点,研究机构与企业需共同推动合规与透明的技术应用环境。展望未来,随着量子计算和深度学习技术的融入,合成酶设计有望迎来新的飞跃。模拟分子级别的复杂反应动力将更加精准,高通量计算将极大提升筛选效率,使得人工智能与物理学的结合更加紧密。
未来新酶不仅会催化更广泛的反应,还可能实现动态调控和智能响应,推动定制化生物催化剂的普及。总之,基于物理知识的算法设计突破了传统蛋白质设计的瓶颈,创造出效率惊人的合成酶,开启了生物催化的新纪元。这一进展不仅丰富了生物学基础知识,也为医药、环保及材料科学铺设了坚实的技术基础。随着相关技术的不断发展,新型合成酶将在促进绿色化学发展和实现可持续目标方面发挥更大作用,助力人类社会迎接更加美好的未来。