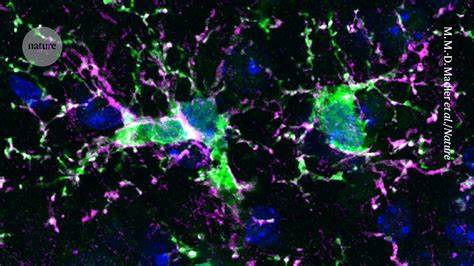
大脑并非免疫豁免区,微小胶质细胞作为中枢神经系统的常驻免疫细胞,承担着监视、清理病理残片、支持神经网络发育和维持稳态等关键职责。随着年龄增长或在某些遗传与环境因素作用下,微小胶质细胞可能发生功能退化或产生持续的炎性反应,进而促进阿尔茨海默病、帕金森病、多发性硬化等神经退行性和炎性疾病的发展。近年来,科学界提出一种有趣且颇具潜力的策略:通过替换衰老或病变的微小胶质细胞,恢复大脑免疫环境的"年轻化"或功能正常化,从而干预或逆转疾病进程。 微小胶质细胞置换的科学逻辑基于两个关键观察。其一,功能异常的微小胶质细胞既可能无法有效清除有害蛋白聚集,也可能释放持续性促炎因子,损害神经元与突触;其二,如果能够安全、可控地将损伤性或失能的微小胶质细胞清除,并让健康来源的细胞占据其生态位,这些新细胞有望恢复清除废物、分泌营养因子和支持修复的能力。动物模型研究显示,当微小胶质细胞被选择性消除后,提供合适的替代细胞可实现一定程度的功能恢复,这为临床转化提供了理论支持。
实现微小胶质细胞置换存在几条主要技术路径。传统的造血干细胞移植(HSC移植)在某些脑病治疗中已有应用经验,其原理是用基因修正或来源健康的造血干细胞替代病变的髓系系统。在特定的脑白质病或溶酶体储积病中,造血干细胞移植能够让外周来源的单核吞噬细胞进入中枢并发挥代偿作用,但能否完全转化为与原生微小胶质细胞同一身份和功能仍是争论点。另一条路径是利用CSF1R抑制剂等药物短暂清除大脑内的微小胶质细胞,随后通过静脉注入或局部移植来源于供体的微胶质样细胞或经基因修饰的干细胞衍生细胞,让这些细胞占据空出的生态位并长期驻留。诱导多能干细胞(iPSC)技术使得从患者自身制备经过修复或基因编辑的微小胶质细胞成为可能,从而降低免疫排斥风险并实现个体化治疗。 这些方法各有优劣且面临共同挑战。
血脑屏障是一个重要物理与生理屏障,限制了外周细胞进入大脑的能力;利用化疗前处理或局部炎性环境可以暂时增加渗透性,但也带来副作用。另外,外周来源的巨噬细胞与胚胎来源的原生微小胶质细胞在发育轨迹、表型与基因表达谱上存在显著差异,替代细胞是否能完全获得原有微小胶质细胞的特殊身份仍需通过单细胞测序、表观遗传学和长期功能评估来验证。免疫排斥和长期安全性问题也不容忽视。任何细胞移植疗法都可能带来植入细胞的不恰当活化、促炎反应甚至肿瘤风险,尤其是当干细胞来源或基因编辑介入被采用时。 在适应症选择上,微小胶质细胞置换在罕见遗传性微胶质或髓系相关疾病中最先显示潜力。例如某些因微小胶质细胞功能缺陷导致的白质退行性疾病和代谢缺陷性疾病,传统药物难以逆转病理,但通过提供功能正常的免疫细胞有可能补偿缺陷并改善神经发育或延缓病程。
对更常见的神经退行性疾病,如阿尔茨海默病,理论上置换能帮助清除淀粉样蛋白斑、减少慢性炎症并支持突触修复。然而,阿尔茨海默病的病理复杂且涉及多重细胞类型与系统因素,单一的微小胶质细胞置换很可能需要与抗蛋白质聚集、代谢调节和生活方式干预等联合应用才能发挥明显疗效。 当前研究进展显示出谨慎乐观的信号。动物实验中,细胞置换可在一定程度上改善炎症状态和认知行为,但不同模型间结果差异较大,且长期随访数据有限。临床前安全性研究正在评估细胞来源、剂量、给药路径以及预处理策略对移植效率与副作用的影响。临床试验的推进需要明确的生物标志物来衡量微小胶质细胞的替换与功能恢复。
影像学技术如PET成像结合特异性配体可以反映炎症活性,但目前分辨原生微小胶质细胞与外周巨噬细胞的能力有限。血液与脑脊液中的分子标志物、单细胞转录组和表观基因组学提供了更精细的评估手段,但也增加了数据解读的复杂性。 伦理与监管层面的讨论同样重要。细胞置换涉及供体细胞或基因编辑技术,如何保证供体安全、细胞质量可控以及基因修复的精确性,是伦理审查和监管审批的关键点。对于可逆性、可控性的设计要格外重视,以便在出现不良反应时能及时干预。患者知情同意过程需要清晰传达潜在收益与风险,避免过度期望或滥用未经充分验证的疗法。
从技术发展方向看,几个趋势值得关注。第一,更精准的微小胶质细胞谱系诱导与成熟策略正在改进,研究者努力让体外来源的细胞在表型与功能上更接近原生微小胶质细胞。第二,局部递送与微环境调控策略旨在提高移植细胞的存活与融合,例如短期调节脑内趋化因子或利用生物材料支架改善定植。第三,结合基因编辑修复致病变异并在移植前进行功能筛选,可以在遗传性疾病中同时解决病因与细胞缺陷。第四,开发更安全的微小胶质细胞消除技术以生成生态位,避免长期使用抑制剂带来的副作用。 展望未来,微小胶质细胞置换并非万能灵丹,但在若干场景中具有重要的治疗潜力。
短期内,最可期待的是针对单基因导致的微胶质功能缺失或代谢疾病的个体化干预;中期可能看到与其他疗法结合的多模态临床研究,例如将细胞置换与抗炎药、抗淀粉样蛋白治疗或康复训练相结合;长期则需要大量循证的随机对照试验来评估对常见神经退行性疾病的疗效与安全性。 对普通公众和患者而言,了解这一领域的科学进展与现实限制很重要。任何临床应用都必须经过严格的临床试验与监管评估。参与临床研究前应咨询神经科与移植领域的专家,了解潜在风险以及试验设计。科研人员需要继续完善动物模型的预测性,开发可靠的生物标志物,并在伦理合规下推动早期人体研究。 微小胶质细胞置换代表了一种从免疫细胞层面重新塑造大脑微环境的创新思路。
随着干细胞、生物工程、基因编辑和神经免疫学的融合发展,这一领域正进入快速演进期。关键在于科学家、临床医生、监管机构与患者社区之间的透明沟通与协作,既不盲目夸大前景,也不轻易放弃对复杂疾病进行根本性干预的追求。未来若能克服安全性、有效性与可及性的瓶颈,微小胶质细胞的"新旧更替"或将成为治疗某些神经疾病的重要补充手段,带来真正意义上的临床益处。 。