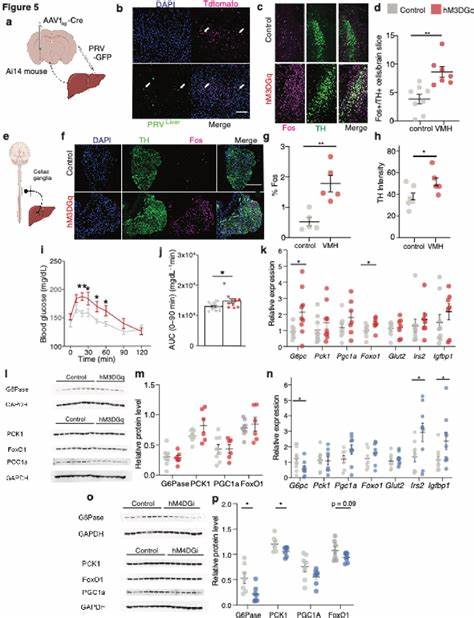
在现代生活中,长期应激与代谢疾病的关联越来越受到重视。最新的基础研究指出,大脑情绪中枢之一的杏仁核并不只管理恐惧和社交记忆,它还能通过一条"杏仁核 - 下丘脑 - 肝脏"轴,迅速改变全身葡萄糖代谢。在面对威胁时,动物需要即时动员能量用于逃逸或防御,而大脑如何在数分钟内把能量需求转化为血液中更高的葡萄糖浓度?新的证据让我们看到了清晰而直接的神经通路和生理逻辑。 研究团队通过一系列行为学和神经回路干预实验发现,位于内侧杏仁核(medial amygdala,MeA)的一类神经元在遇到物理或社交压力时被迅速激活。这些被激活的MeA神经元主要投射到腹内侧下丘脑(ventromedial hypothalamus,VMH),随后通过多跳的多突触网络最终影响肝脏功能,从而在短时间内提升血糖水平。令人特别关注的是,这条通路提升血糖的方式并非依赖传统的肾上腺或胰岛素/胰高血糖素等内分泌激素,而是通过神经性途径直接驱动肝脏的葡萄糖生成(gluconeogenesis)。
研究中使用了多种工具组合来确认回路与功能,包括即时早期基因FOS作为神经激活标记、体内光遗传学(optogenetics)与化学遗传学(chemogenetics)精确地激活或抑制MeA特定投射神经元,以及空间转录组学来鉴定投射到VMH的MeA神经元的分子特征。行为刺激类型涵盖了禁锢(restraint)、领地气味暴露(territorialized cage)、足电刺激与视觉威胁等,几乎所有明显的应激刺激都会在短时间内引起MeA的激活,且该激活在血糖上升之前出现,提示MeA在驱动代谢反应中处于触发地位。 在功能验证方面,研究者发现:用化学遗传学激活MeA整体或特定投射到VMH的MeA→VMH神经元,会迅速并显著提高小鼠的血糖;相反,抑制或削减这些投射会减弱应激引起的高血糖反应。更细致的实验显示,MeA→VMH回路主要由混合的兴奋性(glutamatergic)与抑制性(GABAergic)神经元构成,两类细胞的激活都能促使血糖升高,表明回路功能并非单一神经型态所决定,而是整体网络活动的结果。 令人印象深刻的是,激活MeA→VMH回路并没有显著提升皮质醇(小鼠为皮质酮)或肾上腺素等经典应激相关激素的水平。相反,它驱动了交感神经系统的激活迹象,包括位于脑干的蓝斑(locus coeruleus)与外周的腹腔神经节(coeliac ganglia)中儿茶酚胺系统的上调。
这提示MeA信号通过中枢-外周的交感通路,快速动员肝脏的葡萄糖生成程序,而不是主要依赖血源性激素的改变。 为了直接证明肝脏葡萄糖生成的增加,研究者们进行了丙酮酸耐受试验(pyruvate tolerance test)并结合稳定同位素示踪([2,3-13C]pyruvate)。光遗传学刺激MeA→VMH回路会导致给药后更高的血糖升高,肝组织中与糖异生相关的代谢中间体(如柠檬酸、苹果酸、天冬氨酸等)显示出更高的13C标记,直接证明葡萄糖的新生成增加。此外,肝脏中葡萄糖-6-磷酸酶(G6Pase)等关键糖异生基因的表达也随之上调,进一步支持神经驱动的肝脏代谢重编程。 这些发现的重要性还在于它们为应激与代谢疾病之间的关联提供了明确的机制解释。长期或反复的压力暴露并非简单地维持回路原有的功能,研究显示反复应激可以导致MeA及MeA→VMH回路的反应性减弱,表现为对相同应激刺激的神经活动和血糖反应逐渐钝化。
长期而言,这种回路功能的改变与代谢失衡有关联:实验中当持续削弱该回路(例如用毒素部分耗损相关神经元)时,在高脂饮食条件下小鼠更容易出现空腹高血糖、葡萄糖耐受受损和体重上升,伴随肝脏β2受体表达上调和α2A受体下调的变化,这种受体谱的改变有利于肝脏葡萄糖的输出。 从演化角度看,这种机制合情合理:面对即时威胁时,动物需要快速获得可用能量,直接通过神经通路驱动肝脏释放葡萄糖比依赖内分泌轴更迅速、更可控。然而在现代社会中频繁而慢性的心理压力可能会使这种适应性机制失衡,导致交感调控的长期改变,进而为代谢综合征、胰岛素抵抗与2型糖尿病的发展提供温床。 这些动物实验成果给我们带来几方面的启示。其一,人类的应激管理不仅涉及心理健康,也与代谢健康密切相关。长期高强度心理压力可能通过类似的神经-肝脏通路,影响血糖稳态并增加糖代谢疾病风险。
其二,药物与干预策略如果能够针对中枢-外周的交感通路或调整肝脏对交感信号的敏感性,或许能作为缓解应激相关代谢异常的新方向。例如调节肝脏肾上腺素受体亚型的表达或功能,可能改变葡萄糖输出的倾向。其三,从临床监测角度,评估慢性心理压力史的患者应被纳入代谢风险评估范畴,采取更早的生活方式与医疗干预。 研究也存在局限与待解的问题。首先,这项工作主要基于小鼠模型,尽管脊椎动物在应激相关脑区与交感调控方面存在保守性,但人类杏仁核和下丘脑的组织结构与连接模式更为复杂,需要结合神经影像学、病理学与人群研究来验证是否存在功能上可比的杏仁核 - 下丘脑 - 肝脏轴。其次,MeA内部含有多种神经表型,空间转录组学虽已初步描绘出富集基因与相关通路,但如何在分子层次上精确识别并选择性调控关键亚群仍需进一步研究。
此外,长期应激引起的通路"钝化"机制尚不完全明确,是神经元失活、突触可塑性改变、还是受体表达适应性变化,仍需用电生理、结构连接组学与转录组纵向研究进行追踪。 从公共健康与生活方式的角度出发,这些发现强调了应激管理在代谢健康中的重要性。有效的压力管理策略包括规律运动、充足睡眠、冥想与正念训练、社会支持以及有针对性的认知行为干预,这些方法可降低交感张力、改善睡眠与内分泌反应,可能间接维护中枢-外周代谢调控的稳定。与此同时,在临床上,医生应关注有长期高压工作或情绪困扰的个体的血糖和代谢指标,必要时提前介入生活方式调整或药物治疗,以阻止早期代谢异常向不可逆转的糖尿病演变。 未来研究方向值得期待。将来可探索人类功能性磁共振成像(fMRI)或脑电与代谢监测结合的研究,观察杏仁核-下丘脑网络在心理压力任务中的活动与血糖波动之间的关联。
同时,分子层面的研究可以明确MeA→VMH回路中特异性受体或通路分子,为药物靶向提供候选靶点。另一个有前景的方向是研究生活方式干预或心理干预如何调节该回路的敏感性,以及这种调节是否能长期降低代谢病风险。 总结来看,杏仁核通过投射到下丘脑并经交感神经通路影响肝脏葡萄糖代谢,形成了一条快速动员能量的神经轴。急性应激时,这条通路有助于在几分钟内增加血糖以支持行为反应;而重复或慢性应激可能导致通路功能异常,促进代谢失衡。理解并干预这条中枢 - 外周的连接,不仅丰富了我们对应激生理学的认识,也为预防和治疗与压力相关的代谢疾病提供了新的思路。面对压力带来的代谢风险,从社会、医疗与个人层面同时采取综合干预,可能是降低未来糖代谢疾病负担的关键一步。
。