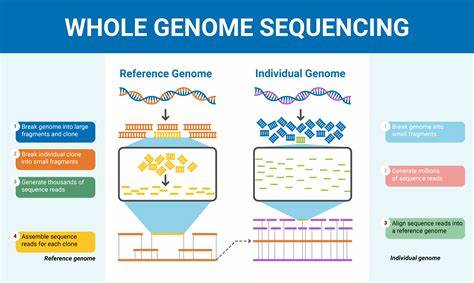
阿尔茨海默病(Alzheimer’s disease,简称AD)作为全球范围内最主要的痴呆症类型,已经影响了超过5700万人的生活。尽管过去几十年的研究不断深入,揭示了部分遗传学基础和病理机制,但仍有大量潜在遗传因素尚未得到充分解析。近期,韩国科学家基于1559位阿尔茨海默病队列的高深度全基因组测序(WGS)研究,开辟了揭示AD遗传因素的新视角,推动了对疾病风险累积模型的理解和构建。全基因组测序技术的深入应用,不仅延伸了传统基因组关联研究(GWAS)主要聚焦于常见变异的视野,也实现了罕见变异、非编码区变异及结构变异的全面挖掘。该研究的成果对从基础遗传学到临床干预都具有深远的意义。传统GWAS多聚焦于欧洲人群,识别的75个AD相关遗传位点仅解释了大约15%的表型变异,提示还有大量的遗传因素待发现。
亚洲人群的遗传背景存在显著差异,不同区域的单核苷酸变异、罕见变异频率和结构变异特征可能揭示新的疾病致病机制。本次研究充分涵盖了东亚韩国人群,结合临床症状、认知功能评估与脑成像标志物——特别是淀粉样β蛋白沉积(amyloid beta,Aβ),提供了精准的基因-表型关联分析。研究中首次在东亚人群中发现APCDD1基因附近的新变异位点与临床诊断相关,且该信号跨越韩国和日本两个独立的队列,增强了结果的可靠性和普遍性。此外,GWAS还识别了SAMD3和PTPRD基因附近的新位点与Aβ淀粉样蛋白的正性表现相关,这些基因此前从未报告涉及AD,揭示了群体特异性遗传风险载体。除了常见单核苷酸变异,该研究也将视野延伸至罕见的编码区及非编码区变异。通过基因基因组级别的稀有变异累积分析,发现DRC7基因携带损失功能或有害错义变异与Aβ沉积相关联。
DRC7的表达显著出现在兴奋性神经元及星形胶质细胞中,暗示其可能参与Aβ蛋白的代谢或清除路径。罕见非编码变异分析方面,该研究采用了创新的类别宽关联研究(CWAS)方法,整合多层次的细胞类型特异性调控注释,系统检视了接近2000万个稀有变异。分析揭示出特定非编码变异簇显著富集于兴奋性神经元的顺式调控元件(CREs),该发现提示非编码变异通过调控基因表达影响认知功能,进一步深刻影响AD病理进展。研究检视18例兴奋性神经元亚型中的单细胞转录组数据后发现,这些非编码变异通过调控多个关联基因表达,与认知功能下降存在密切联系,强化了神经元调控网络对AD致病重要性的认识。在结构变异层面,团队对拷贝数变异(CNV)和短串联重复序列(STR)进行了细致挖掘。尽管CNV数据整体未达到显著性阈值,但HPSE2基因区域的拷贝数缺失呈边缘显著性,有待未来大型队列验证。
STR扩展分析成果尤为突出,这不仅在样本中同欧洲人群研究发现的APOE基因下游STR位点一致,还通过多模型分析显示罕见STR负担显著增加Aβ阳性风险。特别是样本中STR异常扩展超过40重复单位的个体表现出较高的Aβ水平,这种积累效应为AD风险预测提供了新工具。该研究还综合了多种遗传风险因素,包括APOE ε4基因型、多基因风险评分(PRS)、稀有非编码变异和结构变异,提出AD遗传风险的累积效应模型。数据显示,在APOE ε4携带者中,伴随较高的PRS和结构变异负担,认知功能受损更为严重,脑内Aβ累积明显增加。这一模型强调单一遗传因子难以解释AD的复杂遗传景观,强调未来疾病预防和治疗应综合多因素风险管理。值得注意的是,研究团队突出了利用Aβ PET作为核心病理学标志,在遗传学研究中的重要意义。
相比于临床诊断,生物标志物能够更精准地反映AD病理进展,帮助甄别真实AD病例,提升遗传关联研究的灵敏度和准确性。此外,利用单细胞和表观遗传数据辅助基因定位和功能解释,极大扩展了对致病机制的理解。虽然研究取得了诸多突破,但也坦言存在一定局限。当前eQTL和单细胞转录组数据主要基于欧洲人群,未来构建多族群的基因调控资源至关重要。非编码和结构变异功能的进一步验证(如CRISPR技术)仍是亟待解决的挑战。CNV分析的统计功效尚需提升,需依托更大的样本量进行确认。
此外,非编码变异的上下文依赖效应复杂多变,深入机制研究将为疾病靶向治疗开辟新路。展望未来,结合大规模多族群WGS数据、多组学跨层次分析以及精细化临床表型,能够更系统解码AD遗传风险,促进精准诊疗能力提升。全基因组测序作为基因发现和复杂疾病研究的利器,正在转变对阿尔茨海默病遗传架构的理解。这项韩国东亚人群的WGS研究不仅拓宽了AD遗传风险变异的版图,也验证了多因子累积效应模型的重要性,强调了多种遗传因素间的交织对疾病发生和进展的深刻影响。未来结合多样化人群、功能基因组和临床数据协同推进,势必为阿尔茨海默病的早期诊断、风险评估和靶向治疗提供坚实基础,为全球抗击这一致残性疾病贡献中国智慧和力量。