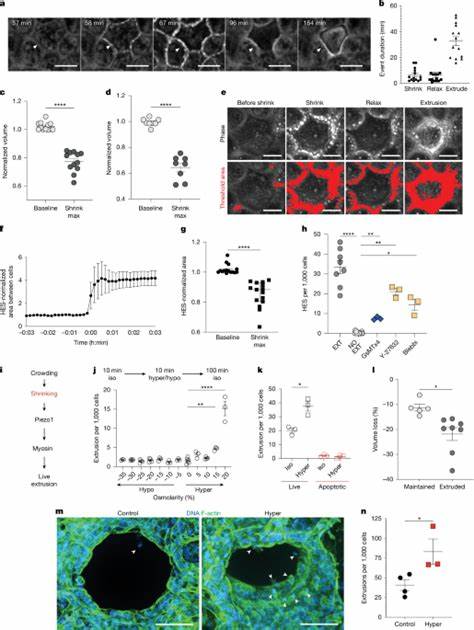
上皮组织需要精密平衡细胞增生与细胞死亡,才能维持屏障功能与器官结构。近年来,研究者发现当上皮局部过度拥挤时,细胞会通过"活细胞挤出(live-cell extrusion)"被从单层中挤出并随后死亡,从而维持细胞数目恒定。然而,究竟是什么信号选择某个处于拥挤区域的细胞成为被挤出的靶标?一项来自Nature的研究提供了新的答案:不是细胞质量或简单的机械缺陷,而是细胞的能量供应和膜电位决定了它们的命运。研究表明,能量不足的拥挤细胞更容易被挑出来,特定的钠、钾和氯离子通道在这一过程中发挥关键作用,为理解上皮细胞周转与相关疾病提供了新的视角。研究的核心发现可以用一个简化的模型来描述:当局部拥挤发生时,位于细胞顶面的上皮上皮钠通道(ENaC)被激活,允许钠离子进入细胞,导致膜电位去极化。大多数细胞可以依靠Na+/K+ ATP酶消耗ATP把膜电位重新恢复到稳态,但那些ATP储备有限的细胞无法有效泵出过量的钠离子而持续去极化。
去极化进而触发电压门控的钾通道(如Kv1.1和Kv1.2)以及细胞体积调节相关的氯通道(如SWELL1)开放,引发钾和氯的外流和随后的水分外移,导致细胞短暂收缩。如果细胞收缩超过阈值(研究指出大约17%),这一体积改变会放大局部拥挤并激活下游的挤出机制,最终使该细胞被邻居的收缩力量挤出并失去生存信号而死亡。实验上,研究团队使用多种细胞生物学与成像技术验证这一连锁事件。研究对象主要是MDCKII肾上皮细胞单层,同时在小鼠肺切片的支气管上皮组织中做了体外精确切片验证。为了排除细胞干质量变化是主要因素,研究者采用定量相位成像(QPI)测量细胞干质量,发现干质量在发生活力挤出前并不显著下降,而在细胞分裂前会明显增加,因此干质量并不是挤出的选择标记。相反,他们发现一个可重复的前驱现象:多数被挤出的活细胞在挤出前出现瞬时体积减小,伴随细胞-细胞连接处在相位显微镜下变得更亮,研究者将这段短暂但关键的体积丧失命名为"稳态早期收缩(homeostatic early shrinkage,HES)"。
这一现象通过共表达细胞质GFP和Calcein‑AM染料得到进一步确认,Calcein荧光因水分流失而淬灭,直接证明了水分外移导致的体积减小。为了测试体积减小是否足以触发挤出,研究团队用短时的高渗溶液处理单层细胞,模拟水分流失。结果显示20%高渗处理在短时间内显著增加细胞短时收缩并诱发挤出,且多数为非凋亡性的活细胞挤出。通过抑制一系列离子通道,研究者发现阻断电压门控钾通道以及体积调节氯通道能有效抑制这种由高渗诱发的体积丧失和随后的挤出。进一步用siRNA靶向敲低Kv1.1、Kv1.2和SWELL1也同样抑制了收缩和挤出,证实这三类通道在HES和挤出过程中的关键作用。令人注意的是,多个细胞膜电位相关的探针在被挤出的细胞上显示了明确的动态变化。
膜去极化的荧光探针DiBAC4(3)在挤出前约五分钟开始亮起,提示去极化先于收缩发生。与此同时,利用CoroNa‑AM钠离子荧光探针观测到,钠离子进入也在收缩之前上升。上述时间关系支持钠入流导致去极化,随后电压门控钾通道打开,最终产生离子和水的外流。ENaC被鉴定为引发初始钠入流的主要候选者,其在顶端定位并可被鉴定的ENaC抑制剂如amiloride阻断了去极化、收缩和挤出。此外,siRNA敲低ENaC的各亚基(α、β、γ)同样显著降低了高渗诱导的收缩和稳态挤出,进一步确认ENaC在机械拥挤下作为"张力探针"的角色。那么为什么只有局部细胞会被挑中?研究者提出关键在于细胞能量状态。
维持膜电位主要依赖Na+/K+ ATP酶的活性,而该酶消耗大量ATP。通过使用ATP指示剂(如ATP‑Red或基因编码的比值传感器Queen37)追踪细胞内ATP水平,研究团队发现被挤出的细胞在去极化与收缩之前其ATP含量已下降。抑制线粒体ATP合成(如oligomycin‑A处理)能显著增加细胞的收缩与挤出频率,而补充葡萄糖则降低挤出率。这些数据支持一个"能量适配性选择"模型:在拥挤条件下ENaC普遍被激活产生钠内流,但只有那些ATP不足、无法通过Na+/K+泵迅速恢复膜电位的细胞会持续去极化并触发后续的离子通道介导的水分丧失与收缩,从而被邻细胞挤出。换言之,上皮通过这种机制检测并排除能量不足或代谢较弱的"劣势"细胞,从而保护整体功能。该研究对上皮稳态、组织修复和疾病机制提出了多方面的启示。
首先,能量作为细胞"适合度"的衡量指标参与了机械竞争与细胞选择,这为理解发育时的细胞淘汰、组织老化以及肿瘤微环境中的细胞竞争提供了新视角。其次,关键通道ENaC、Kv1.1/Kv1.2和SWELL1在挤出过程中扮演中心角色,这些通道在多种疾病中已有报道其表达或功能异常。例如ENaC在囊性纤维化与肺水代谢紊乱中被广泛研究,Kv通道在某些肿瘤的侵袭与预后中也有相关性。因而,挤出机制的异常可能与慢性炎症、气道疾病和癌变过程有关。研究者指出,挤出机制若被抑制可能导致细胞在上皮中堆积,从而破坏屏障或促成瘤样增生;反之,过度激活挤出可能在气道收缩或高压条件下导致过度细胞丢失,损害器官功能。方法学上,该研究展示了如何将多模态成像与功能干预结合以解析复杂生物过程。
定量相位成像提供了对细胞干质量的非染色监测,Calcein‑AM用于验证体积变化,膜电位和离子动态使用DiBAC和CoroNa进行实时记录,ATP动态由基因编码与小分子探针追踪,通道功能通过药理学抑制和siRNA敲低相互印证。研究还在小鼠肺精切片模型中复现了体外细胞实验的关键现象,增强了结论的生理相关性。尽管该工作揭示了挤出选择机制的重要环节,仍有若干关键问题值得继续深化探索。首先,为什么收缩超过某一阈值会不可逆地触发下游Piezo1通路和S1P‑S1P2‑Rho信号轴的激活?研究提示Piezo1可能位于体积变化之后,充当将机械信号转化为挤出实施的开关,但具体的分子链路、膜机械学变化与囊泡释放机制仍需阐明。其次,不同器官和上皮类型在通道表达谱、能量代谢特性及对机械压力的敏感性各不相同,如何在肠道、皮肤或肾脏等组织中推广这些结论需要实地验证。第三,研究中主要聚焦单细胞收缩与挤出是否与组织级电位差或细胞间电流变化相关尚未完全明确,跨细胞电气耦联可能在信号放大或方向性挤出中发挥作用。
最后,从临床角度探索调节这些离子通道或能量代谢能否成为治疗气道疾病、促进组织修复或干预肿瘤发生的新策略,将是转化研究的重要方向。在治疗与诊断的想象空间中,该研究提供了数个切入点。针对ENaC或Kv通道的小分子调节剂有潜力影响上皮细胞的挤出频率,从而用于抑制病理性细胞丢失或促进不适合细胞的清除。在代谢紊乱如糖尿病或慢性炎症中,上皮细胞能量供应可能系统性下降,导致挤出机制异常激活或失调,因此代谢调节或局部补能可能修复上皮屏障功能。对肿瘤微环境而言,肿瘤细胞常有代谢重编程与膜电位异常,挤出选择机制或参与恶性细胞的消除或逃逸,其具体作用仍需实验验证,但无疑为肿瘤免疫与微环境互动提供了新的研究角度。总之,这项研究将能量代谢、膜电位与离子通道连接为决定拥挤上皮细胞命运的关键因素,提出ENaC作为"拥挤感知器"并揭示了一整套上游-下游联动的分子事件。
通过多种细胞成像与功能干预手段,研究构建了一个清晰且可检验的模型:拥挤→ENaC介导的钠内流→能量受限导致的膜去极化→电压门控钾通道与体积调节氯通道开启→细胞水分外流与短暂收缩→收缩超过阈值激活挤出程序。未来的研究将继续解码细胞收缩如何触发Piezo1和S1P信号,以及如何在不同组织中调控这一过程以维持组织稳态或作为治疗靶点。理解细胞如何在能量与力学之间做出"生死抉择",不仅是基础生物学的前沿问题,也与多种临床疾病密切相关,具有广泛的研究与应用前景。 。