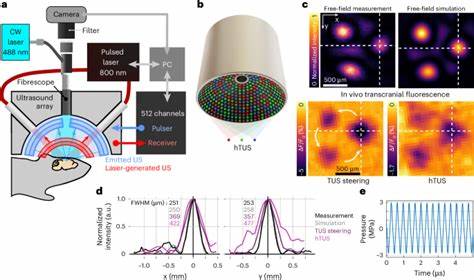
在现代神经科学研究和临床治疗中,调节脑功能的重要性日益凸显。尤其是在神经退行性疾病、抑郁症等多种脑部疾病的治疗需求中,非侵入性的脑刺激技术受到了高度关注。传统方法如经颅磁刺激(TMS)和经颅直流电刺激(tDCS)虽有一定疗效,但在深层脑结构定位精度和刺激范围掌控方面存在局限。经颅超声神经调控(Transcranial Ultrasound Neuromodulation, TUS)凭借其在穿透力和聚焦精度上的显著优势,成为了新一代神经调控技术的代表。特别是全息经颅超声技术(hTUS)的出现,更是在精准度和刺激效率上带来了极大革新。全息经颅超声神经调控技术基于超声波的相控阵列,通过计算数字化聚焦,实现对脑内多个靶点的同步刺激,从而调动分布式脑网络,有效降低激活阈值并增强神经反应。
技术原理方面,传统单点TUS通常依赖单元素换能器产生局限于单个深度和范畴的焦点,刺激体积较大且不可控。hTUS则利用512通道的球面阵列,覆盖超过150°的空间范围,通过独立控制阵列中不同元件的发射时间,相位和振幅,形成可编程的空间声场,实现多焦点、异形焦点甚至动态可变焦点的超声作用。该方法不仅突破了单点聚焦在空间覆盖和频率变换上的限制,还大大增加了刺激的灵活性和精准性。实验证据表明,hTUS在小鼠大脑皮层的应用能够诱发清晰、局限且可控的钙信号激活,显示出强烈的区域性神经兴奋反应。相较于传统的单点TUS,hTUS能够以远低于单点刺激所需的声压实现相似甚至更强的神经活性,这说明其在激活网络节点时发挥了协同效应。结合宽场钙成像技术,研究人员观察到hTUS不仅激活焦点处的神经元,还通过神经网络连接诱导周边相关区域的同步响应,体现了刺激的"多点共振"机制。
这种现象对理解神经回路互动和脑功能组织提供了独特视角。为了深入解析hTUS刺激所带来的复杂神经动力学变化,研究团队开发了双模型框架,包括经验性模型和基于电生理机制的简化神经网络模型。经验模型揭示出基于辐射力(radiation force)的刺激参数对于神经激活概率具有较强预测能力,且解释了为何hTUS在相同声压下更易于诱发反应。机制模型则模拟了神经元膜电位的动态变化,结合多节点互联的网络结构,展示了当多个节点同时受到刺激时,协同的兴奋输入如何显著降低触发动作电位的阈值,并增强激活持续性。此外,该模型还考虑了温度效应的调节作用,证明当前实验条件下超声刺激引起的局部温度上升对神经元功能影响有限。hTUS技术的临床与研究应用潜力令人瞩目。
首先,其高空间分辨率和深度穿透力使其适合作用于难以通过光学或电磁方法到达的深部脑结构,为帕金森病、抑郁症等疾病提供了可能的新型非侵入式干预手段。其次,hTUS的动态电子控形能力便于在实时监测指导下调节刺激方案,实现个性化治疗。此外,结合多模态脑成像技术,可实现靶点精准定位,减少副作用。尽管hTUS展现了巨大优势,但当前仍面临诸多挑战。其一是对超声与神经组织相互作用的基础机制尚未完全明了,尤其是细胞膜机械-电耦合的具体途径仍需进一步探究。其二,跨物种跨度的参数调优及安全阈值界定需要更多人体和大型动物模型的系统研究。
其三,阵列设备的复杂性及对计算资源的需求也限制了该技术的普及和便捷使用。未来的发展方向包括深化超声神经激活的分子机制研究,提升阵列设计以实现更高密度的电子控形,结合AI算法实现实时反演声场及反馈闭环调控,并与其他脑刺激或药物治疗手段融合,开辟多模式综合精准神经调控路径。总的来说,全息经颅超声神经调控作为一项技术先进、应用前景广阔的脑刺激新方法,不仅提升了神经功能调节的精准度和效率,也为神经科学的基础研究提供了强有力的工具。这一技术的继续完善和推广,有望推动神经疾病治疗进入一个非侵入、高效且个性化的新纪元。 。