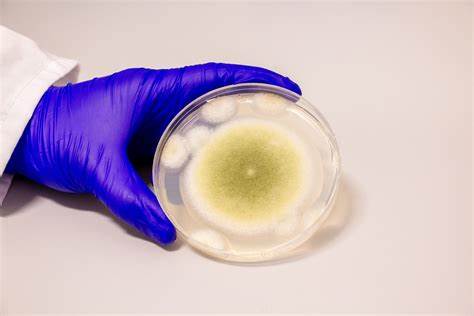
近年来,癌症治疗领域的研究不断取得突破,尤其是在寻找天然来源的新型治疗药物方面。宾夕法尼亚大学工程与应用科学学院的研究团队通过创新方法,将一种曾被视为致命威胁的真菌——黄曲霉(Aspergillus flavus)转变为一种潜在抗癌化合物。这项研究不仅揭示了黄曲霉这种真菌的特殊生物合成能力,也为未来抗癌药物的开发提供了新的思路和路径。 黄曲霉因其黄色孢子而得名,长期以来被视作农业危害和致病源。历史上,黄曲霉毒素与多起神秘死亡事件有关,尤其是在考古古墓开掘中,曾出现多名工作人员出现肺部感染甚至死亡,被传为“法老诅咒”。这些事件让公众对这种真菌敬而远之。
然而,正是这种被误解的真菌,蕴藏着未被盯上的生物活性化合物,成为本次研究的突破口。 研究团队通过系统的基因组分析和代谢物筛选,发现黄曲霉能够产生一类被称为“核糖体合成后修饰肽”(RiPPs)的特殊化学物质。RiPPs是由细胞内的核糖体合成初级肽链后,通过复杂酶促修饰形成的,这种修饰极大增强了化合物的生物活性。虽然细菌产生多种RiPPs被广泛研究,但在真菌中,这类化合物的发现极其有限,部分原因是长期以来科学界对真菌RiPPs的误分类和合成路径理解不足。 研究团队首先筛选了十余个黄曲霉相关菌株,通过对比代谢产物与基因簇信息,确认黄曲霉是最具潜力的研究对象。通过基因敲除实验,他们证实特定蛋白质的生成与RiPPs的合成直接相关。
当关闭相关基因后,RiPPs的化学标志消失,进一步验证了其合成机制。这种结合代谢和遗传学的多维手段为寻找更多真菌RiPPs树立了标杆。 最终,研究者从黄曲霉中纯化出四种全新结构的RiPPs,称之为“曲霉环肽”(asperigimycins)。曲霉环肽具有独特的多环互锁结构,这种结构赋予了极强的生物活性。实验证明,这几种化合物对人类白血病细胞表现出显著抑制效果,其中两种曲霉环肽在未经过改造的情况下就能有效杀死癌细胞。 更令人惊喜的是,研究团队对其中一种曲霉环肽进行了脂质修饰,即添加了与蜜蜂蜂王浆中相似的脂肪分子。
这种修饰大大提升了其抗癌活性,与临床上广泛使用的抗白血病药物阿糖胞苷(cytarabine)和达诺鲁滨(daunorubicin)效果不相上下。脂质修饰不仅增强了化合物的细胞穿透力,还改善了其药代动力学特性,为后续药物设计提供了有效策略。 为了探明脂质如何提升曲霉环肽的细胞内进入效率,研究团队进一步对白血病细胞进行了基因调控研究。结果发现一个名为SLC46A3的基因在此过程中扮演关键角色。该基因编码的蛋白质可以促进化合物从细胞内的溶酶体出口,增加其在细胞质中的积累。SLC46A3的“门控”作用,不仅为曲霉环肽进入癌细胞打开通路,也可能适用于其他环状肽类药物的递送。
此外,曲霉环肽通过抑制癌细胞的微管形成,阻断细胞分裂过程,展现出针对肿瘤细胞特有的细胞毒性。这种选择性作用避免了对正常细胞及其它癌种(如乳腺癌、肝癌和肺癌)以及细菌和真菌的广泛损害,减少了潜在的副作用风险,体现了其作为治疗药物的安全性和有效性。 此次研究不仅为癌症治疗带来了新希望,也揭示了真菌王国中丰富多样的化学生态学。通过深入分析其他真菌基因组,团队发现类似的RiPPs基因簇广泛存在,表明真菌这一类生物资源宝藏尚未被充分开发。随着科学技术的进步,未来有望从更多真菌种类中发现具有独特疗效的天然产物。 当前,研究团队计划将曲霉环肽进行动物模型测试,以评估其体内疗效和安全性。
这一步骤是实现临床应用的重要前提,也是将实验室成果转化为实际药物的关键。团队成员均表示,对曲霉环肽的未来充满信心,期待通过更加精细的分子设计和药物优化,开发出更加有效和安全的抗癌药物。 本次研究代表了跨学科合作的典范,涵盖了生物工程、化学合成、分子生物学及医学等多个领域,得到了美国国立卫生研究院以及多家科研基金的支持。研究成果发表在国际顶尖期刊《自然化学生物学》(Nature Chemical Biology)上,获得学术界高度评价。 从科技伦理的角度来看,利用自然界中的有害真菌资源开发药物,既体现了负责任的创新理念,也彰显了人类利用自然智慧克服疾病的能力。未来,结合人工智能与基因编辑技术,探索真菌天然产物的潜力将成为医学领域的热点之一。
总结来看,宾夕法尼亚大学工程师团队成功将一种潜在致命的真菌转变为强效抗癌化合物,开创了真菌天然产物药物开发的新纪元。曲霉环肽的发现不仅展示了真菌丰富的化学生态多样性,更为癌症患者带来了福音。随着研究的不断深入,相信这种源于自然的神奇“抗癌武器”将在未来医疗中发挥更加重要的作用,为人类战胜癌症贡献力量。