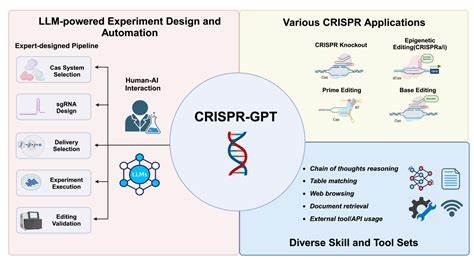
随着基因编辑技术的日益成熟,CRISPR-Cas系统已成为现代生物医学和生命科学研究的基石。精准、高效的基因编辑不仅推进了基础科学的探索,也为治疗遗传疾病、癌症等重大疾病开辟了全新路径。然而,基因编辑实验涉及复杂的设计流程,从系统选择、引导RNA设计到递送方法的筛选及数据分析,每一步都要求科研人员具备深厚的专业知识和丰富的实验经验。面对这一复杂挑战,CRISPR-GPT应运而生,成为基因编辑领域智能自动化的开拓者。CRISPR-GPT是一套以大语言模型(LLM)为核心驱动的智能代理系统,旨在自动化基因编辑实验的设计与分析过程。它不仅继承了大语言模型强大的语言理解与推理能力,更通过专门的指令调优、学科知识融合以及信息检索技术,提升了对基因编辑专业领域问题的解决能力。
系统基于多代理架构,包括任务规划器、用户代理、任务执行器和工具提供者等模块,协同完成从实验规划到数据分析的全流程支持。CRISPR-GPT支持四大基因编辑模式:基因敲除、碱基编辑、引物编辑以及表观遗传调控,为不同研究需求提供定制化方案。系统设计了三种用户交互模式,分别适合入门研究者和高级专家,既可提供循序渐进的指导,又能实现自由形式的自动化任务拆解和执行,还能解答基因编辑领域的实时科研疑问。通过与人类研究者的交互协作,CRISPR-GPT极大地简化了基因编辑实验的复杂度,帮助用户准确选择CRISPR系统,设计功能精准的sgRNA,优化递送策略,并生成详尽的实验操作流程。技术实现上,CRISPR-GPT采用了链式推理和任务状态机的设计理念,使复杂的实验流程分解为一系列具体可控的步骤,每一步都能根据实际反馈进行调整和优化。此外,系统利用检索增强生成(RAG)技术,从权威文献、公开讨论及专家协议中实时提取最新的科学资讯,保证建议的科学性和时效性。
引导RNA设计是CRISPR-GPT的一大亮点。相比传统软件仅基于序列匹配和评分规则,CRISPR-GPT能够结合生物学功能域与基因结构知识,智能推荐位于关键功能区的高效靶点,避免设计落入无效的无关区域。这一点在实际癌症基因BRD4的编辑中体现尤为明显,系统成功匹配到关键外显子,实现了基因敲除的预期生物学效应。实验递送途径的选择历来是基因编辑的难点,涉及细胞类型、转染效率及生物安全性等多维度因素。CRISPR-GPT通过结合用户输入与文献数据,自动归类生物模型,筛选最适合的递送法,并依据被引量进行优先排序,尤其在处理难以转染的原代细胞和细胞系时,表现出较基线模型显著的优势。实验规划模块则负责根据用户需求,智能拆解宏观目标为任务序列,确保步骤顺畅且逻辑自洽。
丰富的基因编辑测试集验证了CRISPR-GPT的任务执行准确率超过99%,在任务组成和步骤排序上也表现出近乎完美的匹配度。此外,CRISPR-GPT在科学问答模式下,通过结合专门调优的CRISPR领域模型和权威文献检索,能够提供准确、简洁并具深度的答案,对于复杂实验中遇到的技术难题和故障排查尤为有效。这显著提升了科研人员尤其是初学者的自主解决能力。为确保安全合规,系统内置了严格的伦理风险控制机制。针对人类基因组编辑和潜在的遗传危害,CRISPR-GPT在用户操作时提供警告提示并要求确认遵守国际道德规范,防止不当应用。此外,隐私保护策略阻止敏感的长序列数据上传到外部模型,保障受试者隐私和数据安全。
CRISPR-GPT不仅在计算平台实现了高度自动化,更通过实地湿实验验证了其实用价值。两位初学者在全程无专业基础情况下,依托该系统成功完成了四基因敲除和两基因激活实验。编辑效率均高达80%以上,相关生物功能实验也验证了基因编辑的预期效应,显示出系统在实际科研中的辅助潜力。面向未来,CRISPR-GPT的模块化设计为整合更多基因编辑前沿技术和机器学习模型提供了便利。结合自动化实验室机器人,未来有望实现从实验设计到执行乃至数据反馈的全链路闭环自动化,极大提升科研效率和精准度。虽然系统已展现卓越能力,但依然存在提升空间,如应对极其复杂的罕见生物系统或罕见突变型设计等方面尚需优化,同时数据与模型的持续更新维护亦是挑战所在。
总结来看,CRISPR-GPT是大语言模型技术与生命科学深度融合的成功范例,其智能代理系统有效降低了基因编辑门槛,提升实验设计和分析的质量与效率。它不仅加速了个性化精准医学和农业生物技术的革新进程,也为未来更多学科交叉型人工智能科研工具的研发奠定重要基础。未来,基因编辑领域有望借助类似CRISPR-GPT的AI驱动系统,实现从“人工设计”到“智能创造”的转变,开创生命科学研究的新篇章。