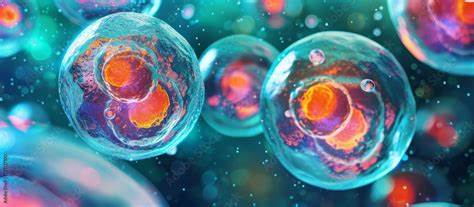
细胞培养是一项将细胞从动物或植物体内分离出来,在人工控制的实验室环境中进行生长和繁殖的技术。随着生命科学的迅速发展,细胞培养已成为揭示生命奥秘、推动医疗进步的重要工具。通过提供恰当的营养物质、温度、pH值等条件,细胞能够脱离体内环境,在体外继续其自然状态下的功能表现。细胞培养不仅丰富了基础科学研究手段,也在药物筛选、疫苗生产和组织工程等领域展现出巨大潜力。细胞培养的多样性主要体现在培养方式的不同,通常可分为贴壁培养和悬浮培养。贴壁培养中,细胞依附于培养器皿的表面,适用于许多固有依附生长特性的细胞类型;悬浮培养则允许细胞悬浮于营养液中,常用于血液细胞以及某些肿瘤细胞。
细胞来源亦有广泛差异,从新鲜组织直接获得的原代细胞,到经过多代传代得来的细胞系,不同细胞类型的培育需求迥异,因此针对不同实验目的,科学家们设计了多样化的培养方案。细胞培养的过程需要严谨的操作规程和无菌技术支持。首先,样本的采集和细胞的分离是基础步骤,常见方法包括机械剪切和酶解法,通过酶如胰酶等促进细胞从组织中解离。随后将细胞接种于含有优化配方的培养基中,培养基中通常包含葡萄糖、氨基酸、维生素、无机盐及血清等成分,为细胞生长提供必要物质。实验室环境必须通过恒温箱维持适宜温度和湿度,同时以二氧化碳气体调节培养基的酸碱度。细胞培养的健康状况需要不断监测,研究人员通过显微镜观察细胞形态、密度及增殖状态,及时更换培养液和补充养分以保证细胞的活力。
此外,当细胞达到培养皿最大承载密度时,科学家们会通过传代操作,将细胞分离并转移至新的培养容器中继续培养,以实现细胞数量的持续扩大。为了长期保存珍贵的细胞资源,细胞冷冻保存技术得以应用。利用液氮超低温环境和冻存保护剂如二甲基亚砜,细胞可以在长时间内维持活性,防止遗传漂变和灭失。细胞培养中的无菌操作至关重要,任何细菌、真菌或支原体的污染都会极大影响实验结果和细胞状态。为此,实验操作必须在洁净的层流工作台或生物安全柜中进行,所有器具和培养基需严格消毒。除污染外,细胞系的真实性鉴定和纯度检测也是保证实验数据可靠性的关键环节。
与此同时,不同细胞类型对环境条件的要求不尽相同,温度、二氧化碳浓度、培养基成分的微小变化都可能导致细胞增长异常或功能失调。因此,科学家需对细胞特性进行深入了解并不断优化培养参数,确保实验的成功。细胞培养技术的广泛应用范围极为丰富。作为基础科学研究的支撑,它帮助解析细胞分裂、代谢、信号传导等生命活动的基本机制。药物研发过程中,借助细胞培养对新药候选分子进行初步筛选及毒性检测,大幅提高研发效率与安全性。疫苗生产也广泛依赖于细胞培养技术,通过大量培养病毒感染细胞,实现疫苗病毒的扩增。
此外,细胞培养在生产生物制剂如抗体、酶、激素等方面也发挥着核心作用,为现代医学提供了重要药物支撑。毒理学研究通过细胞模型评估环境污染物及化学品对生物体的潜在危害。癌症研究中,癌细胞系提供了肿瘤发生发展的体外模型,促进新疗法的探索。基因编辑和基因治疗领域依赖细胞培养进行精确的遗传操作和功能验证。组织工程和再生医学的兴起更是依赖于细胞培养技术,科研人员通过细胞在特定支架上的培养,试图构建可移植的人造组织甚至器官,极大地推动了医疗临床前景。近年来,细胞培养技术朝着更高的自动化和智能化方向发展。
自动化系统能够取代传统手工操作,执行培养液更换、细胞传代等重复性任务,不仅提高效率,还减少人为失误。结合先进传感技术和人工智能,监控细胞的生长状况和环境参数,实现无创实时监测和智能调控,推动实验数据的标准化和可重复性。尤其值得关注的是新兴的三维细胞培养技术,包括类器官和细胞球体等,能更真实地模拟体内组织结构和功能,为疾病模型和药物测试带来革命性进展。与此同时,开发无血清的化学定义培养基为细胞培养提供了更稳定和安全的选择,避免了动物血清引入的变异和污染风险。基因编辑技术如CRISPR-Cas9的应用,使得科学家能够精准设计细胞基因组,创造具备特定功能的新型细胞,为合成生物学和精准医疗铺路。细胞培养技术还催生了细胞农业和人工肉等新兴产业,旨在通过体外培养细胞替代传统畜牧业,缓解环境压力,推动可持续发展。
展望未来,细胞培养必将融合更多跨学科技术,打造更精准、高效和便捷的平台,为生命科学的探索和人类健康带来前所未有的突破。随着智能化监测设备如开发中的Cadmus系统逐步投入应用,细胞培养的标准化和数据驱动管理将迎来新纪元,极大增强研究的可靠性和临床转化的成功率。细胞培养作为现代生物技术的基石,不断推动着从基础研究到临床应用的多重进步。其潜力远不止于目前的成就,未来将以更多创新和应用场景,持续塑造科学和医疗的未来面貌。