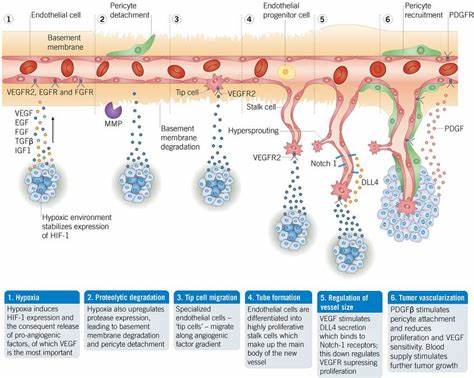
血管生成是人体内一种关键的生物学过程,指新血管由已有的血管分支形成的现象。这是人体在胚胎发育、生长、伤口修复以及病理状态下维持组织活力的基础机制之一。血管生成不仅仅局限于新血管的形成,更涉及血管网络的动态重塑和功能优化,保障细胞获得必需的氧气与营养,并促进代谢废物的清除。血管生成的研究历程深厚,现代医学也不断利用这一过程开发多种治疗手段,涵盖肿瘤癌症、心血管疾病到视网膜病变等领域。理解血管生成的机理及调控机制,对于解锁众多疾病的治疗密码具有重要意义。血管生成通常在胚胎发育初期由“血管发生”(vasculogenesis)开始,指的是胚胎最初形成内皮细胞并构建原始血管网络的过程。
而血管生成主要承担大部分后续血管的拓展工作,涵盖血管芽生(sprouting angiogenesis)、血管分裂(intussusceptive angiogenesis)及血管融合(coalescent angiogenesis)等多种形式。血管芽生是最为人熟知的血管生成方式,过程中,位于原有血管端部的毛细血管“尖端细胞”响应缺氧信号分泌血管内皮生长因子(如VEGF),激活血管壁上的受体,释放酶类降解基底膜,促使内皮细胞迁移并增殖,逐渐向需求区域延伸形成新的毛细血管。相比之下,血管分裂是通过在已有血管腔内形成侧膜并最终将血管一分为二,通过这种方式快速增加毛细血管网络的密度。血管融合则是部分毛细血管相互合并,形成更大口径的血管通路,加强组织血流供应和循环效率。血管生成受多种机械与化学信号调节。机械力方面,血流剪切力及组织张力等环境刺激对血管内皮细胞行为具有调控作用,虽具体机制尚在研究中,但运动过程中肌肉收缩增加局部血流,有助于提高血管内皮生成活性。
化学信号则关键依赖多个生长因子与蛋白质的协同作用。最为人熟知的是血管内皮生长因子VEGF,它能促进内皮细胞增殖、迁移及形成管腔结构,同时增强血管通透性。成纤维细胞生长因子(FGF)在血管平滑肌细胞和纤维母细胞的分化与增殖中发挥重要作用,对新血管壁结构的稳定至关重要。血管生成素(Ang1和Ang2)作为调节血管成熟与稳定的关键蛋白,通过与Tie受体结合调和血管紧张及结构完善。基质金属蛋白酶(MMP)在降解血管基底膜和细胞外基质中起作用,促进内皮细胞迁出,而Delta样配体4(Dll4)则作为负调控因子,通过Notch信号通路限制血管过度芽生,维持血管网的有序发育。血管生成不仅是正常生理过程的基础,还成为多种疾病的核心环节。
例如在肿瘤发展中,肿瘤细胞通过分泌大量VEGF和bFGF等促血管生成因子,刺激邻近血管新生,从而获得充足的营养和氧气支持。肿瘤血管往往形态不规则且结构异常,这与肿瘤的快速增长和转移密切相关。正是这一机制的发现推动了抗血管生成疗法的兴起,旨在切断肿瘤的血液供应,抑制肿瘤生长。临床上,贝伐珠单抗等针对VEGF通路的药物已广泛应用于多种恶性肿瘤的治疗中。相较肿瘤,血管生成在心血管疾病治疗中呈现另一面。当血管堵塞引起组织供血不足时,促进血管生成成为恢复血流的重要手段。
通过蛋白质替代疗法、基因治疗及细胞疗法等多种策略,科研人员尝试诱导新生血管形成以改善心肌缺血症状。尽管动物模型的试验结果令人鼓舞,但临床应用中的挑战仍然存在,如血管网络的功能性与稳定性、治疗的精准递送及免疫反应等。运动则是激发生理性血管生成的重要因素,尤其在耐力训练中,组织对氧气和营养的需求增加,促进毛细血管密度上升,有利于提升肌肉耐力和代谢效率。因此,理解运动如何通过血管生成改善身体功能,对于设计科学健身方案和康复训练有积极意义。此外,血管生成在眼科疾病如湿性老年性黄斑变性中起重要负面作用。异常的血管生成导致视网膜下新生血管扩张及渗漏,造成视力丧失。
抗VEGF药物的应用显著改善了这类患者的治疗效果。组织工程领域同样高度依赖血管生成的研究成果。为保证移植组织的存活与功能,必须实现充分的血管化。血管生成相关因子如PDGF的使用,有助于稳定新生血管,促进植入组织与宿主的整合。血管生成的发现及研究有着超过两百年的历史。18世纪末,约翰·亨特首次对新血管生长进行观察,而现代血管生成研究则以1971年犹大·福尔克曼提出的“肿瘤血管生成假说”为里程碑,揭示了血管生成在肿瘤进展中的决定性作用。
自此,血管生成成为生物医学领域的重要研究方向之一,不断推动抗癌、再生医学等领域的技术革新。尽管已有大量研究成果,血管生成的完整机制及其在机体不同环境中的调控网络仍需深入解析。未来,随着分子生物学、系统生物学及人工智能的融合应用,血管生成的治疗手段将更加精准和个性化,能够有效控制病理性新生血管,促进生理血管的建成与维护。无论是在癌症治疗、心血管修复还是组织再生领域,血管生成研究都将继续扮演关键角色,引领医学进步的新浪潮。