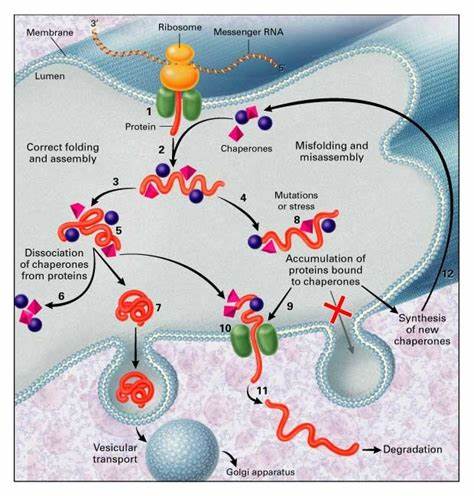
蛋白质的正确折叠是细胞生命活动的基础,尤其在内质网这一蛋白质生物合成与修饰的重要细胞器中,协助蛋白质达到其功能性三维结构的分子伴侣网络发挥着不可或缺的角色。近期研究发现,一种以蛋白二硫键异构酶家族成员PDIA6为核心的多重分子伴侣凝聚体,在内质网内形成了钙离子依赖的相分离现象,极大地整合了各类伴侣蛋白的协同作用,提高了蛋白质折叠的效率和准确性,为我们理解内质网蛋白质折叠机制提供了革命性的视角。蛋白质折叠的过程复杂而精细,任何一个环节出现异常都可能导致淀粉样沉积和各种相关疾病的发生。内质网中的分子伴侣系统正是为保障蛋白质折叠的正确性和细胞稳态而存在。传统上,伴侣蛋白如Hsp70家族成员BiP、J域蛋白ERdj3、蛋白二硫键异构酶PDIA1等被认为是通过动态相互作用实现协作,但其空间和时间上的整合机制尚不清晰。最新的科学发现指出,PDIA6能够在内质网腔内形成高度集中的凝聚物,即生物学中的液-液相分离(LLPS)结构,这种凝聚体富集并招募其他关键伴侣蛋白,构建了一个多重伴侣复合平台。
该平台不仅增强了蛋白质折叠效果,同时在折叠失误预防中发挥重要作用,构筑了细胞内抗蛋白质错误折叠的第一道防线。PDIA6凝聚体的形成过程表现出显著的钙离子依赖性,低浓度的钙离子不足以促进凝聚体的形成,而高浓度钙离子则驱动凝聚体快速聚集。这种依赖机制正好对应了正常内质网中钙离子浓度与细胞应激状态下钙浓度的变化,使细胞能够根据环境动态调控伴侣网络的构型和功能,及时响应蛋白质折叠负荷的变化。这种调节方式也解释了为什么在内质网应激条件下,例如诱导剂调控或错误折叠蛋白积累时,PDIA6凝聚体会解体,释放伴侣蛋白以应对紧急需求。结构生物学研究进一步揭示了PDIA6的多域构象特征,尤其是拥有两个催化活性的硫氧还蛋白样结构域(a0和a域)和一个非催化的b域。其a0域通过特定铰链区段介导高亲和力的二聚化,并且灵活的连接链段与b域通过电荷相互作用,在钙离子的调控下实现多价结合,进而驱动液态液相分离的形成。
这种机制确保了PDIA6凝聚体的动态稳定性和响应性,为伴侣蛋白的空间组织提供了分子基础。功能上,PDIA6凝聚体不仅吸引了核心折叠伴侣Hsp70家族的BiP,还聚集了调节其活性的J域蛋白ERdj3、蛋白二硫键异构酶PDIA1以及Hsp90家族成员Grp94,但未包含负责后期糖基化折叠的钙结合伴侣如Calreticulin和Calnexin。这种选择性募集表明该凝聚体专注于蛋白质的早期折叠阶段,形成高效的"折叠工厂",通过受控且集中的环境优化客户蛋白的成熟路径。实验中,通过共定位分析发现这类凝聚体内客户蛋白如前胰岛素(Proinsulin)高度富集,显示其作为折叠反应中心的功能。更令人关注的是,当通过突变破坏PDIA6连接链区段而阻止凝聚体形成时,细胞中胰岛素的成熟分泌显著下降,错误折叠蛋白的积累增加,内质网应激信号被激活,且细胞存活率降低。这从功能层面充分证明了凝聚体结构对内质网蛋白质折叠和维护蛋白质稳态的关键作用。
多重伴侣凝聚体不仅通过提高伴侣局部浓度和客户蛋白结合率,提升折叠效率和专一性,还可能通过减少非专一性相互作用,降低误折叠和聚集风险。同时,其动态调控能力让细胞可以在不同的生理或应激状态下灵活调整伴侣的空间布局,优化蛋白质生物合成流程。生物相分离近年来被公认为细胞内形成功能区室的一种普遍机制,是实现空间和时间组织的有效策略。此次内质网伴侣网络的分子凝聚体发现,填补了内质网蛋白质折叠领域中伴侣组织形式的空白,拓宽了我们对蛋白质质量控制的认识。同时也提示,调节这些液态凝聚体的形成及稳定性,可能成为未来治疗蛋白质折叠相关疾病如糖尿病、肿瘤等的新策略。随着蛋白二硫键异构家族成员PDIA6在多种疾病病理中的关联性不断显现,针对其调控伴侣凝聚体功能的药物设计具备巨大的临床潜力。
展望未来,对PDIA6凝聚体与其他伴侣之间相互作用的精细调控机制、客户蛋白如何被动态招募进出凝聚体、以及凝聚体在各种细胞类型和生理状态中的调节,都将是重要的研究方向。更广泛地,此项研究启示我们应重新审视细胞内分子伴侣网络的组织形态,从单一蛋白互作视角转向多蛋白多价作用下的整体结构与动力学,借助前沿技术如高分辨显微、核磁共振和分子动力学模拟等,揭示生命活动复杂调控的底层逻辑。多重伴侣凝聚体作为内质网功能的重要模块,其发现不仅促进我们理解基础细胞生物学,更为精准医学提供全新切入点。因此,解密多伴侣凝聚体的构建和调控机制,将为改善蛋白质折叠紊乱导致的疾病防治打下坚实基础,开辟生物医药领域的新前沿。 。