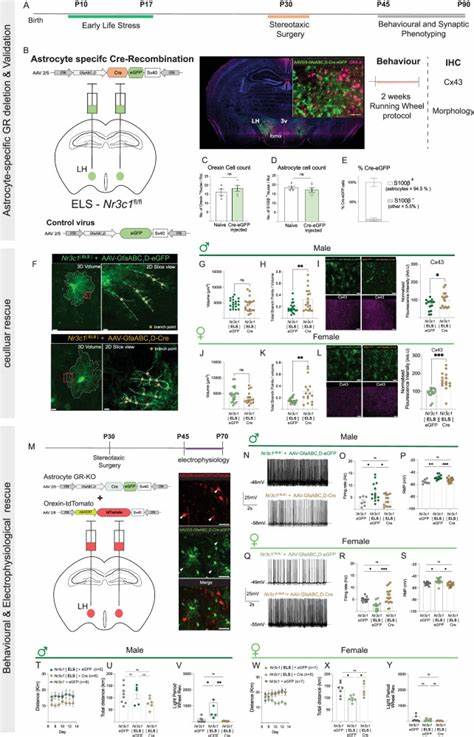
在神经科学领域,星形胶质细胞作为大脑中重要的非神经元细胞,一直以来备受关注。它们不仅维持神经元的代谢支持和环境稳态,还参与调控神经传递和塑性。最新研究指出,星形胶质细胞对压力的响应存在性别特异性,影响雄性与雌性小鼠的行为模式和神经元活动。这一发现为探究压力相关神经精神疾病的性别差异提供了关键线索。 压力,尤其是早期生命阶段的应激体验,已被证实能对大脑发展和功能产生长远影响。通常,与压力相关的疾病如抑郁症和焦虑症在男女之间的发病率和表现存在显著差异,但其背后的机制尚未完全厘清。
近期一项发表在权威期刊《自然通讯》的研究通过对小鼠模型的深入分析,揭示了催眠素神经元及其周围星形胶质细胞在应激反应中的关键角色,特别强调了雄性和雌性之间机制的不同之处。 催眠素神经元位于侧下丘脑,是调节觉醒状态、活动水平及动机行为的核心节点。研究利用了早期应激(ELS)模型,在小鼠出生后第10至17天进行母鼠分离和环境改变,以模拟生命早期遭受的压力。实验结果显示,ELS导致成年小鼠血浆中的皮质酮水平显著升高,这种激素变化在雄性和雌性中均有表现,提示压力激活了体内的糖皮质激素轴系统。 在行为层面,雄性ELS小鼠表现为光照期活动的增加,典型的超活动状态,而雌性则表现出暗期活动的减少,呈现活跃度降低的趋势。通过安置跑轮监测,小鼠的日夜活动节律被细致捕捉。
值得注意的是,这种差异并非源自昼夜节律中心(如视交叉上核)本身的变化,而是更可能由侧下丘脑局部机制介导。 对催眠素神经元的电生理记录进一步证实了这一点。雄性ELS小鼠的催眠素神经元显示出静息膜电位的去极化和自发放电率的增加,意味着神经元更加兴奋活跃;相反,雌性ELS小鼠的相应神经元则表现出发放率降低,尽管其静息膜电位同样经历去极化。这一现象提示应激对神经元兴奋性调控机制存在性别依赖性差异。 星形胶质细胞形态和功能上的变化为上述现象提供了细胞基础。研究证明,EGL导致侧下丘脑星形胶质细胞的体积缩小和支枝长度减少,尤其在雌性小鼠中表现得更为显著。
星形胶质细胞中关键的间隙连接蛋白 - - 连接蛋白43(Connexin-43)及中间丝蛋白GFAP的表达均受到应激的负面影响,显示胶质细胞功能阶段性的紊乱。 为何星形胶质细胞会在压力作用下改变,并进而影响神经元功能?核心机制之一在于胶质细胞与神经元间的能量代谢支持,尤其是星形胶质细胞通过乳酸穿梭系统为神经元提供能量的能力。ELS雌性小鼠中,星形胶质细胞间隙连接蛋白下降导致乳酸转运受阻,使得催眠素神经元得不到充足的代谢支持,其兴奋性降低,可通过外源乳酸补充部分逆转这一状态。 相较而言,ELS雄性小鼠的机制则更多涉及胶质细胞释放的ATP和其对神经元局部兴奋的调节。研究中发现,雄性ELS小鼠中催眠素神经元的超活跃依赖于P2X受体介导的ATP信号通路。药理抑制P2X受体能有效降低其神经元发放率,提示胶质细胞通过加强嘌呤能信号调控神经元活动,驱动行为中的超活动模式。
进一步解析压力信号在星形胶质细胞中的传导,糖皮质激素受体(GR)成为关键靶点。研究采用小鼠基因敲除技术,特异性删除侧下丘脑星形胶质细胞中的GR,结果显示,这种干预不仅从细胞形态学层面恢复连接蛋白表达及支枝复杂性,也调节了催眠素神经元的异常发放,最终显著矫正了ELS引起的性别特异性活动变化,雄性行为中的过度活跃被抑制,雌性行为也部分恢复正常。 上述发现对于神经精神疾病研究具有重要启示。传统焦点多集中于神经元自身的改变,而新兴数据强调了胶质细胞,尤其是星形胶质细胞在应激诱导的神经病理过程中的核心作用。星形胶质细胞不仅是被动的支持细胞,更是信息调节和代谢供应的主动参与者,能整合外周激素信号与神经环境变化,促进或抑制神经元功能。这种多细胞协同机制可能解释了为何相同的应激因子在不同性别中产生截然不同的行为结果。
性别差异的分子和细胞基础则进一步丰富了理解。早期生命阶段,星形胶质细胞发育存在差异,影响其后续对外界环境及内源性激素的响应。此外,遗传和表观遗传机制可能导致雄性和雌性胶质细胞在信号传递和代谢功能上的差异。这种异质性使得针对星形胶质细胞的治疗策略需更加精准和个体化,考虑性别和发育阶段等因素。 同时,这一研究也扩展了我们对昼夜节律调控的理解。侧下丘脑作为觉醒-睡眠模式的关键节点,星形胶质细胞与神经元间的交互不仅影响觉醒阈值,也参与能量平衡和活动规律的形成。
应激扰动下的胶质细胞形态及功能改变,可能导致整体神经网络节律失调,影响个体在日常生活中的活动水平和质量。 未来研究可进一步探索星形胶质细胞与其他神经胶质细胞如小胶质细胞、少突胶质细胞在应激反应中的协同作用,以及其在不同脑区的差异特性。此外,鉴于糖皮质激素以及其他代谢激素如胰岛素、瘦素、胃饥饿素对星形胶质细胞的影响,研究其如何共同调控神经元网络和行为亦为潜在突破口。 综上所述,星形胶质细胞在压力刺激下的响应不仅对神经元功能产生显著影响,同时表现出明显的性别特异性。了解这一机制有助于揭示压力相关神经精神疾病中复杂的性别差异,为开发更为有效的个体化治疗方案奠定基础。未来,促进胶质细胞健康功能的策略,尤其是针对糖皮质激素信号通路的干预,可能成为调整神经活动和恢复正常行为的重要方向。
科研人员和临床工作者应高度重视胶质细胞与神经元的多层面互动,共同推进脑科学与精神健康领域的发展。 。