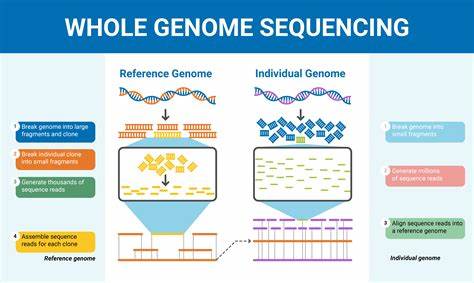
阿尔茨海默病作为全球最主要的痴呆症类型,其发病机制一直是神经科学领域的重大挑战。尽管过去数十年遗传学研究在发现多种风险位点方面取得了重要进展,但已知的遗传因素仅能解释部分表型差异,且多集中于欧洲人群,使得亚裔及其他多样性族群的遗传背景尚未完全揭示。近日发表在《自然通讯》上的一项基于韩国大型阿尔茨海默病队列的全基因组测序(WGS)研究,系统挖掘了常见变异、罕见编码与非编码变异及结构变异,揭示出了此前未被报道的多个新遗传相关位点,揭示了疾病遗传风险的复杂累积效应模式。此次研究集合了1559名韩籍参与者,涵盖认知正常、轻度认知障碍及阿尔茨海默病不同认知状态,通过高深度测序与多组学数据整合,细致剖析了疾病相关遗传变异和生物标志物之间的联系。 研究首先通过全基因组联合分析,确认了APOE基因已知的风险效应,同时发现了接近APCDD1、SAMD3及PTPRD这三个位点,显示其与临床诊断或脑内淀粉样蛋白沉积密切相关。APCDD1在进展中的阿尔茨海默病患者的脑细胞中表达逐渐升高,尤其是在少突胶质前体细胞中,暗示其可能参与神经退行性过程或细胞通讯调控;而SAMD3与PTPRD则在兴奋性神经元或星形胶质细胞中表现出差异表达,与认知功能相关性较强。
这些发现突破了以往仅聚焦于欧洲血统人群的限制,展示了针对东亚族群的研究能够挖掘更多特异性遗传因子。除了常见基因变异,研究进一步聚焦罕见编码区变异,发现DRC7基因的多种罕见错义变异与淀粉样蛋白阳性状态呈负相关,提示其可能具有保护作用。DRC7涉及细胞内部运输系统中的动力蛋白复合物,过去研究表明动力蛋白功能异常可能影响淀粉样蛋白清除,促进病理积累。罕见变异对复杂疾病影响的深度挖掘,为寻找潜在疗法靶点提供了新视角。非编码基因组区域,尤其是细胞特异性的顺式调控元件,在调控基因表达层面发挥着关键作用但过去研究有限。这项研究采用先进的分类范围关联研究(CWAS)方法,通过对基因调控网络和细胞类型特征注释的结合,发现兴奋性神经元特异性的非编码顺式调控变异与阿尔茨海默病风险呈正相关,且携带这些变异的个体表现出显著的认知功能下降。
基于Hi-C染色质三维交互数据可见,这些非编码变异可影响多种基因的表达,进一步证实了非编码变异参与阿尔茨海默病发病机制的可能。结构变异是近年来逐渐受到重视的基因组变异类型,包括拷贝数变异和短串联重复扩展等。研究团队利用多种生物信息学工具整合了多个结构变异检测方法,鉴定了涉及HPSE2基因区域的拷贝数变异,其与淀粉样蛋白沉积呈边缘显著性关联。此外,短串联重复(STR)扩展调控了阿尔茨海默病风险,尤其是在APOE基因区域的STR扩展被证实为一个重要的遗传风险因子。通过统计模型分析,发现携带多种遗传因素的个体—包括APOE ε4等常见风险等位基因、高多基因风险得分(PRS)、罕见非编码变异及结构变异—在认知能力衰退及脑内淀粉样蛋白水平上的表现更为严重,验证了遗传因素对疾病风险的累积效应。这种累积模型解析为未来精准预测个体化风险及开展个体化干预提供了基础。
研究不仅扩展了我们对阿尔茨海默病遗传基础的理解,也强调了对多样性族群遗传学的需求和重要性。东亚人群如今逐渐成为全球基因组研究的重要组成部分,能够弥补以往单一人群研究的不足。同时,研究利用多层次的生物信息学方法、单细胞基因表达及调控元件数据,实现了从基因变异到细胞功能影响的多尺度解读。尽管研究取得显著进展,但科研人员指出目前研究仍存在诸多限制,主要包括样本量不足导致统计功效有限,以及现有基因表达和单细胞数据主要来自欧洲血统人群,如何构建和应用东亚特异的分子数据集以更精准地校验遗传信号是未来重要方向。此外,非编码变异的生物学效应仍需通过实验验证,比如CRISPR基因调控分析,才能明确其在神经退行性过程中的具体作用机制。总体而言,该研究利用先进的全基因组测序技术和多维数据分析手段,成功识别了多个新颖的阿尔茨海默病遗传风险因子,深刻揭示遗传风险累积对疾病发展的贡献,促进了对复杂神经退行性疾病遗传架构的全面理解。
随着基因组测序技术的不断发展和大规模多族群协作研究的推进,未来我们将更全面地揭示不同族群中的疾病遗传异质性,推进遗传风险预测和靶向治疗策略的实施,为阿尔茨海默病患者带来更精准和有效的医疗方案。通过携带多种遗传因素个体的风险评价与早期干预,叠加环境与生活方式调控,有望实现疾病发病延缓甚至预防的目标。阿尔茨海默病作为公共卫生的全球难题,亟需发挥遗传学研究的优势,结合分子生物学、神经影像、临床表型和环境因素构建多维风险模型,推动疾病诊断与治疗创新。此次来自韩国的阿尔茨海默病全基因组测序研究无疑为该领域注入了新的活力和视角,也为全球多样性人群的遗传学挖掘树立了典范。未来需要跨区域多中心合作,集成更多族群样本和纵向随访资料,进一步揭示遗传变异、基因表达与神经病理变化的动态关系,助力揭开阿尔茨海默病复杂的发病机制之谜。