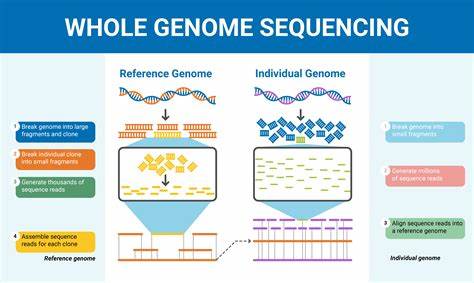
阿尔茨海默病作为全球最常见的神经退行性疾病之一,对患者及其家庭带来了巨大挑战。随着病患人数的持续增长,科学界对于其发病机制的探索日益深入,尤其在遗传学领域展开了多角度的研究。全基因组测序(Whole Genome Sequencing,WGS)作为一种强大的基因检测技术,能够全面捕获个体所有遗传信息,为揭示阿尔茨海默病的复杂遗传背景提供了前所未有的机遇。近年来,基于全基因组测序的研究不断涌现,特别是在东亚人群中,已发现若干此前未被报道的与阿尔茨海默病相关的新型遗传位点,这些发现不仅补充了欧美人群研究的不足,也丰富了全球范围内的疾病遗传学知识库。阿尔茨海默病遗传学研究的一个重要挑战是其高度复杂的遗传结构。传统的基因关联研究大多聚焦于常见基因变异,且样本多为欧洲血统个体,难以完全解释病症的遗传率。
目前估计阿尔茨海默病的遗传力大约为60%至80%,然而大部分遗传贡献尚未被揭示。全基因组测序的应用突破了这一限制,能够同时识别常见和稀有变异,涵盖单核苷酸多态性、拷贝数变异、结构变异甚至短串联重复序列的扩增,从而构建更全面的遗传风险模型。在韩国东亚大规模队列中开展的全基因组测序研究显示,阿尔茨海默病不仅与已知的APOE ε4等经典风险等位基因密切相关,还存在多个之前未被发现的基因区域,诸如APCDD1、SAMD3及PTPRD等,均与认知障碍及β-淀粉样蛋白积累呈显著相关。这些基因涉及细胞信号传导、神经炎症反应和细胞黏附等多重神经系统功能,为揭示阿尔茨海默病发病机制开辟了新视野。尤其值得关注的是,稀有非编码区域的变异,这些变异位于兴奋性神经元特异的顺式调控元件内,可能通过调节基因表达影响疾病进展。此前非编码基因组被视为“无用区域”,然而现代研究揭示其在基因调控中的重要性。
通过整合单细胞染色质开放性数据和三维基因组学技术,研究者能够具体解析这些变异如何影响神经元的功能状态及其对认知能力的影响。此外结构变异,特别是短串联重复序列的异常扩增,被证明可能增加阿尔茨海默病风险。此类变异难以通过传统基因芯片技术检测,全基因组测序提供了新的检测手段。因STR的多态性与神经退行性疾病如亨廷顿舞蹈症相关,其与阿尔茨海默病的联系引发了学界的高度兴趣。研究发现,具有高多基因风险评分(PRS)的APOE ε4携带者通常表现出更严重的认知功能损伤和更高的β-淀粉样蛋白水平,提示遗传风险因素呈累积效应对疾病表型产生影响。这一发现有助于解释为何同样的遗传背景人群中,阿尔茨海默病的临床表现存在巨大差异,也为未来个性化风险评估和精准医疗策略奠定了基础。
在实际应用中,结合全基因组测序结果与临床生物标志物如脑内β-淀粉样蛋白PET造影数据,使得基因遗传学的发现能更准确地映射到疾病的病理进程,在早期诊断、疾病分型以及疗效评估中发挥关键作用。尽管当前全基因组测序在阿尔茨海默病研究中取得了诸多进展,但依然存在样本规模有限、族群多样性不足及非编码区功能验证难度高等挑战。未来需要整合更大规模、多种族的样本库,结合转录组学、表观遗传学及功能实验,更深入地解析遗传变异的生物学效应。同时基因编辑技术如CRISPR为验证非编码变异的功能提供了强有力工具,有望推动基础发现向临床转化迈进。总之,全基因组测序为阿尔茨海默病遗传学研究带来了革命性变化,揭示了多样化且复杂的遗传风险因素,呼吁研究者在不同人群开展深入探究,并结合多组学数据展开跨学科协作。随着相关技术的不断进步和数据积累,期待全面阐明阿尔茨海默病的遗传机制,最终指导精准预测、预防和治疗策略的实现,惠及全球数以千万计的患者及家庭。
。