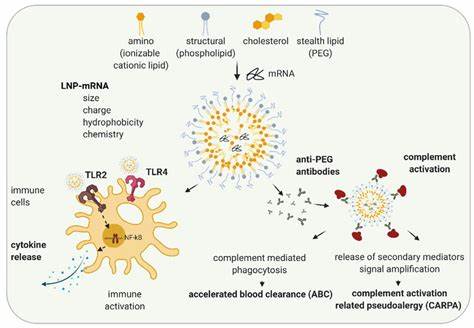
炎症性肠病(Inflammatory Bowel Disease,简称IBD)是一类慢性肠道炎症性疾病,严重影响患者的生活质量。尽管现有治疗方案不断优化,IBD患者仍面临治疗周期长、药物副作用及疗效不均的挑战。近年来,分子靶向治疗成为研究重点,尤其是利用核酸药物实现对疾病相关基因的精准调控,开启了炎症性肠病治疗的新纪元。锁核酸(Locked Nucleic Acid,LNA)作为第三代反义寡核苷酸,以其高度的结合亲和力和特异性引起了科学界的广泛关注。结合脂质纳米颗粒(Lipid Nanoparticles,LNP)技术,LNA在肠道炎症的精准递送与治疗上展现出巨大的潜力。锁核酸是一种通过化学修饰使核糖环结构"锁住"的寡核苷酸,其具有更高的稳定性和结合亲和力,能够有效靶向并调控特定mRNA,实现基因沉默或剪接调节。
传统LNA治疗面临高剂量导致的副作用风险和低细胞摄取率的问题。脂质纳米颗粒则为LNA提供了高效、靶向的输送载体。LNP由电离性脂质、胆固醇、辅料脂质及聚乙二醇(PEG)修饰脂质组成,具备良好的血液稳定性和组织穿透能力。其电离性脂质在生理条件下带中性电荷,减少非特异性细胞膜结合,进入细胞后于酸性内涵体环境正电荷化,破坏内涵体膜实现核酸药物释放。近期研究通过设计多种新型电离脂质筛选出最佳配方,大幅提升了LNP负载LNA在肝脏、脾脏及肠道炎症部位的递送效率,且不增加细胞毒性。研究人员采用小鼠炎症性肠病模型,比较LNAs未载体和LNP载体两种给药体系。
结果显示,载脂质纳米颗粒的LNA递送能够减少30倍剂量,达到同等甚至更优的治疗效果。以抗肿瘤坏死因子α(TNFα)的LNA为例,LNP介导递送不仅显著降低了肠道炎症指标,还减少了炎症相关细胞因子IL-6和IL-1β的表达,同时控制体重下降和肠道长度缩短等临床症状。上述优势归因于LNP在炎症部位的有效富集及多细胞类型的高效摄取。免疫细胞如巨噬细胞、中性粒细胞,及肠道内皮细胞均表现出较高的纳米颗粒结合率,确保靶向区域内LNA的高效递送和功能发挥。细胞实验显示,LNP负载的LNA在多种肠道相关细胞系中均能有效介导剪接调控,表明其广泛的应用潜力。安全性方面,经过严格检测,LNP-LNA体系未观察到肝脏酶指标异常及免疫系统紊乱,充分显示其良好的生物相容性和安全性,为临床推广奠定了基础。
发展LNP作为LNA递送平台的关键还在于离子脂质的合理设计。结合脂质的结构多样化,包括亚油基链和可降解酯键等,不仅提升了稳定性与载药量,还优化了生物降解与代谢路径,减少长期蓄积风险。同时,纳米颗粒粒径通常控制在50至70纳米之间,兼顾了生物分布的有效性和组织穿透性。调节PEG密度实现颗粒表面"隐身"效应,延长血液循环时间,提高了炎症区域的积累概率。未来,结合纳米技术进步和病理机制剖析,将通过表面修饰靶向特定肠道细胞亚群,如巨噬细胞表面特异性受体,进一步提高治疗选择性,减少脱靶效应。此外,多模态治疗策略的融合,如联合小分子抗炎药或免疫调节剂,配合LNP递送LNA,可能带来协同治疗潜力。
炎症性肠病的复杂病理决定了个性化治疗需求,LNP-介导LNA递送的灵活性有助于实现针对患者特定基因表达异常的定制化方案。整体而言,锁核酸结合脂质纳米颗粒的技术革新为肠道炎症治疗带来了突破性的前景,不仅实现了剂量大幅降低,提升了疗效和安全性,还为核酸药物在炎症和其他复杂疾病中的广泛应用铺平道路。借助持续优化的载体设计和靶向策略,未来有望推动LNA-LNP疗法走向临床,惠及更多炎症性肠病患者并改善其生活质量。 。