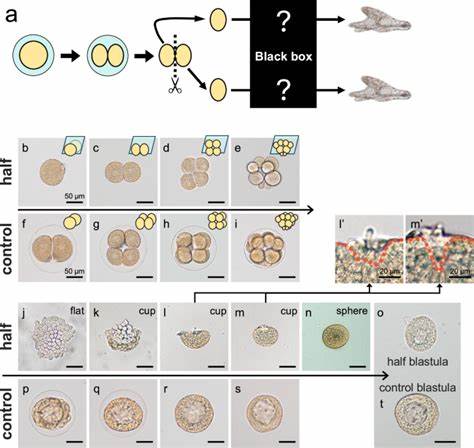
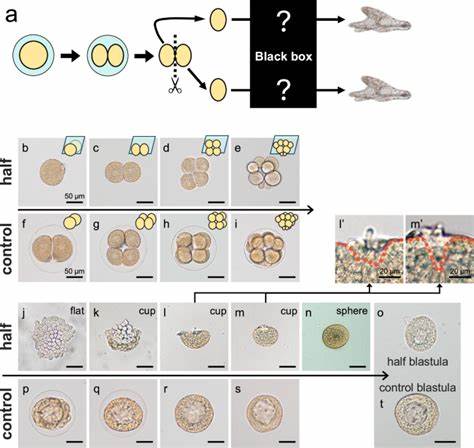
海胆作为模式生物,在胚胎学研究中具有重要地位。自1891年Hans Driesch首次发现早期动物胚胎即使被切割,仍能发展成完整个体以来,科学界对胚胎自我调控与调节发育能力的探讨从未停歇。特别是海胆同卵双胞胎的形成机制,为揭示早期发育弹性和细胞命运决定提供了宝贵窗口。近期一项发表于《自然通讯》的研究,采用现代分子生物学技术,彻底解析了日本海胆Hemicentrotus pulcherrimus二细胞期细胞分离后的发育过程,阐明了胚胎自我组织与轴线重建的分子机理。研究发现,与完整胚胎发展为典型球状囊胚不同,分开的单个胚球细胞首先形成扁平的单层细胞板,随后边缘升起为杯状,再逐渐闭合成球体形态,最终重建具备完整发育潜能的囊胚。该过程并非依赖增殖而是靠细胞形态学的转变完成。
利用活体成像技术,该研究观察到细胞基底侧特异的肌动蛋白-非肌球蛋白(actomyosin)聚集,以及侧足细胞间桥连结构 - - septate junctions的形成,共同驱动细胞由扁平向圆球形极致拉伸。这些细胞形变伴随着细胞极性的保持,维持了细胞的单层排列。通过干扰肌动蛋白聚合及非肌球蛋白活性,研究证实这两者对形态转变至关重要。此外,通过抑制septate junction相关蛋白Tetraspanin的表达,胚胎无法完成扁平杯状到球体形态的转变,体现了细胞间牢固黏附对整体构型稳定的必要性。 这一形态重组过程索引的是一种细胞自主的形态调控机制,不依赖于通常参与胚胎轴向建立的关键信号通路。相比之下,轴线的重建则需要重新激活内源性信号。
尤其是Wnt/β-catenin信号通路在胚胎形成球体后被重新激活,促使原先处于相邻位置的前后身体轴极点分离,实现了前后轴(A-P轴)的重建。这一动态过程给予胚胎巨大韧性,使其在早期被切割后依旧能够正确建立三维形态轴和分子梯度,保证后续形态发生的准确进行。 通过对胚胎不同时间点的基因表达谱进行主成分分析,研究揭示基因表达在杯状期与球状期发生显著偏离,随后迅速恢复至正常波形,暗示分子转录层面的高度调节能力。前体标记基因FoxQ2表达在杯状期异常升高,表明发育轴向的紊乱。前期被破坏的A-P轴,经过Wnt/β-catenin介导的调节,最终趋向正常对极定位。此外,非经典Wnt信号通路中的JNK成分也参与了这一轴向重塑。
对海胆胚胎的动物极细胞进行染色追踪确认,表明多数前部指定细胞位置发生移动,而后部指定细胞位置较为稳定,焯明轴向重构中前部定位的移动更为关键。 另一方面,背腹(D-V)轴的重建表现出更为复杂的动态,研究揭示杯状期胚胎中nodal与lefty基因表达广泛但尚未局部化,随着球状体的形成,这些基因的表达逐步局部化于未来的腹侧区域。Nodal信号的稳定表达依赖于FoxQ2的空间调控,这一调控同样受Wnt轴向重组调节的影响。BMP2/4信号途径在球状期后被激活,进一步支持D-V轴的建立。总的来说,A-P轴的重组成为D-V轴建立的先决条件,轴向间的互作保证胚胎形态与功能的完整构建。 本研究的意义不仅在于揭示了海胆同卵双胞胎胚胎自我调节的具体细胞分子机制,更宏观地体现了胚胎发育的鲁棒性与灵活性。
在环境环境或内部损伤下,胚胎可依靠细胞骨架重塑与细胞间连接,主动调整组织构型,同时再利用早期发育阶段的信号体系,恢复发育轴的准确性。这种机制的揭示对理解多细胞生物体早期发育的自组织本质、细胞命运决定的可逆性具有深远影响。更为重要的是,这些发现在再生生物学与人工组织工程领域具备潜在启示,例如诱导组织自主组装、构建具备功能完整性的细胞团块等。 此外,不同海胆物种间细胞形态变化的差异 - - 如Hemicentrotus pulcherrimus中观察到极显著的细胞轴向拉伸,而其他物种表现差异 - - 表明了自我调节进化过程中的多样性,有待未来深入比较研究。利用来自基因组数据库的丰富资料,结合细胞生物学实验,未来研究或可阐明这一多样性背后的分子机制,为系统生物学提供范例。 海胆胚胎自187年前Hans Driesch首次提出以来,关于胚胎再生及自我调节的研究不断深化,呈现出跨越经典胚胎学到现代分子发育生物学的精彩演进。
当前研究对半胚体从形态学到分子通路的连贯探究,以透彻澄清发育过程中细胞自主与信号路径的相互作用,为发育生物学领域注入新的活力和视角。结合实时活细胞成像、基因干扰技术及高通量转录组分析,这一研究框架为深入理解动物早期发育机制树立了典范。 理解海胆同卵双胞胎胚胎的发育调控,有助于揭示生命系统如何确保发育精确性,同时保留应对扰动的弹性,为发育异常防治、再生医学和器官工程奠定理论基础。未来也期待将该模型系统与脊椎动物如青蛙的发育自我修复机制进行比较,挖掘跨物种的演化保守策略,推动干细胞研究和生物工程的创新发展。 。