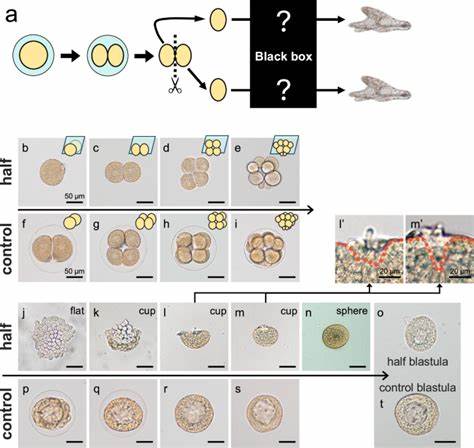
海胆作为海洋生物中的经典模式生物,一直以来都是发育生物学研究中的重要对象。早在1891年,德国生物学家汉斯·德里施便通过海胆胚胎进行了一系列开创性的实验,发现将胚胎分割后,两个2细胞阶段的胚胎能够独立发育,形成完整的个体。这种现象体现了胚胎的调控性发育特性,也即胚胎具有极强的自我组织和调节能力,能够从部分细胞开始重新建立自身的发育规划。这不仅为胚胎发育的灵活性提供了学理依据,也成为解释同卵双胞胎形成机制的关键启示。近日,研究团队通过现代分子生物学技术,重新审视和解析了海胆同卵双胞胎的发育过程,揭示了促使胚胎从被分割后的不规则状态恢复并完成发育的细胞形态和分子调控机制。 在海胆的早期胚胎发育阶段,当将2细胞胚胎中的单个细胞独立提取培养时,细胞最初表现为一个扁平的单层结构,随后该单层边缘上翘形成杯状,最终闭合成一个球形。
这一过程并非依赖于细胞数目的增加,而是由细胞形态的显著变化驱动,细胞沿着顶底轴方向拉长,使得细胞如圆锥体般排列,顶端汇聚形成内腔。此形态转变的实现依赖于细胞骨架中的肌动蛋白-肌球蛋白(actomyosin)系统在细胞基底侧的活跃聚集与收缩,以及细胞间通过密闭连接结构 - - 节段连接(septate junctions)所产生的强大粘附力。这两者协同作用,支持了杯状结构最终闭合为球形,继而引发胚泡的形成。这一发现不仅明确了早期细胞结构变化的物理基础,也强调了细胞自主调控在自我组织过程中的核心地位。 值得关注的是,节段连接组件如四跨膜蛋白tetraspanin以及ZO-1在该过程中扮演了重要角色,其基因在胚胎各阶段的均匀表达保证了细胞间的粘附。研究中应用反义寡核苷酸(morpholino)抑制这两种蛋白的表达,结果显示胚胎无法正常完成从扁平至球形的转换,呈现细胞错位和多层结构异常,表明细胞间机械连接对保持胚胎整体结构稳定性不可或缺。
相较于传统发育信号通路的干预(如Nodal、BMPs等),本阶段的形态重塑更多依赖细胞自身的物理及机械机制,表明胚胎形态的建立包含了深层次的细胞动力学自组织属性。 形态转变之后,胚胎的体轴组织也经历了剧烈重排。尤其是前后轴(anterior-posterior axis)和背腹轴(dorsal-ventral axis)出现短暂紊乱,原有的前后极点在球形形成时被迫接触融合,导致轴向定位暂时模糊。但海胆胚胎通过重新激活Wnt/β-连环蛋白信号通路,成功实现了轴向的再建。Wnt信号在胚胎发育中的重要性已被广泛证实,其在海胆的萌发期维持后极身份的特征表达,而在调控性发育的情况下,该信号重现激活,促使前极标记基因foxQ2从近邻后极表达区域向对侧迁移。此过程对重塑正确的体轴模式至关重要,若阻断Wnt/β-连环蛋白信号,则轴向重建失败,基因表达错乱,胚胎发育受阻。
此外,非经典的Wnt信号通路也参与此过程,其中涉及的JNK信号对前极区域的位移和轴向确定具有部分调节作用。沿体轴的信号梯度的重建,使得胚胎能够重新建立起发育序列,进而触发背腹轴的稳固。研究显示Nodal和Lefty这类变形生长因子家族成员的表达,在形状重塑及轴向再组织期间出现了遍布的、非区域特异的表达,随后的发育阶段才恢复为正常的背腹轴分布。这种先期扩散后局部化的表达模式,暗示背腹轴的设定依赖于前后轴的准确建构,显示出不同轴向系统之间存在功能上的高度协同性。 细胞追踪实验进一步支持了轴向重组的机制。标记海胆胚胎动物极细胞后在发育晚期发现,原来动物极细胞的位置发生了明显转变,大部分细胞最终定位于侧方外胚层,少部分甚至位于后方区域。
这说明,在胚胎受损后,前极区域不仅是基因表达上的改变,更伴随着细胞命运和位置的动态变化。反之,后极细胞保持相对稳定的位置和命运,这种极性差异为轴向再建提供了细胞水平的支撑。 在形态学层面,海胆细胞在胚胎分割后的发育表现出明显的顶底极性,顶端贴附于细胞外基质(ECM),底端则通过节段连接与邻细胞粘附,这种极性自2细胞期即已确立且保持自足。这种结构基础产生了独特的胚胎扁平结构,随后伴随节段连接的形成及基底侧肌动蛋白活性激增,使得细胞沿顶底方向拉长,极大促进了球形胚泡的形状形成。与传统发育依赖的信号传导不同,这种形态重构体现了细胞自主调控与物理力学的整合,揭示了胚胎形态塑造的多维度调控机制。 本研究不仅重现了历史上经典的Driesch实验还通过现代分子与细胞生物学手段深入解码了自我组织的分子基础。
结果表明,海胆胚胎在遭受物理分割后仍具备高度的发育塑性,这种塑性通过细胞骨架动力学、细胞间连接和信号通路的重新激活得以维持。自我组织不仅仅是胚胎细胞被动响应损伤,更是基于细胞自主性质与环境信号协同作用的结果,确保了发育稳健性和个体完整性的恢复。 值得一提的是,类似机制可能在多种模式动物中存在,如两栖类青蛙(Xenopus)胚胎在劈分和伤口愈合过程中也显示出轴向信息的暂时紊乱与重构,并依赖β-连环蛋白的极化实现修复。这提示了发育过程中自我组织的进化保守性,显示了生物体面对环境与内在扰动时所具备的适应乃至再生能力。 未来的研究可进一步探讨调控性发育过程中的信号网络相互作用与机械力学反馈机制,特别是细胞骨架如何感知和整合外部环境信号实现精确的形态重塑。同时,不同物种间自我组织机制的异同也值得深入分析,这不仅有助于揭示发育的基本规律,也可能为再生医学和组织工程提供理论基础和技术指导。
综上所述,海胆同卵双胞胎的形成过程揭示了胚胎调控性发育的深层机制,细胞通过自身的物理属性和信号通路的灵活调控,实现了从部分细胞到完整体的自动建构。这一发现不仅丰富了发育生物学的理论体系,也为理解复杂生命现象中的自我组织特征提供了重要视角。随着科学技术的不断进步,深入剖析胚胎发育的自我修复能力将有助于推动生物学、医学以及生物工程领域的跨越式发展。 。