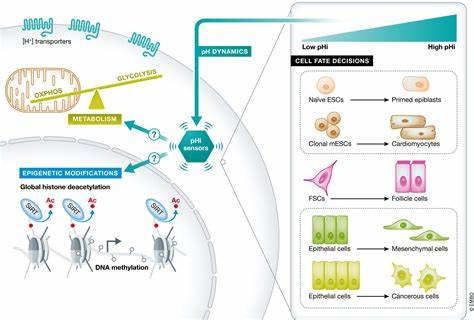
组织再生是生命体修复损伤、维持功能完整的核心机制。长期以来,科学界对细胞命运决定机制的研究主要聚焦于转录调控与信号通路。然而,最新研究显示,代谢不仅是细胞能量供应的基础,更在调节细胞命运过程中扮演着关键角色。代谢适应通过影响细胞状态和分化路径,成为塑造组织功能不可或缺的一环。本文以最新发表于《自然》杂志的研究成果为基础,深入解析代谢如何指导组织再生或修复过程中细胞的命运抉择,重点介绍三羧酸循环(TCA循环)中的代谢酶及其代谢产物对肠道上皮细胞命运的调控机制,揭示代谢与表观遗传的交互作用,并探讨在炎症性肠病等疾病治疗中的潜在应用。肠道上皮细胞的多样性和高更新率为研究细胞分化中的代谢动态提供了理想模型。
肠道中,干细胞位于隐窝底部,具有自我更新能力以及分化为多种不同细胞类型的潜能,包括吸收细胞和分泌细胞两大主要谱系。这些细胞谱系不仅在形态和功能上存在明显差异,其代谢需求与代谢状态也迥异。研究发现,吸收细胞表现出高表达的TCA循环酶,尤其是α-酮戊二酸脱氢酶复合体的关键酶OGDH,其表达受上皮细胞特异转录因子HNF4的调控而显著上调,保证了吸收细胞充足的能量供应和生物合成需求。相较之下,分泌细胞谱系内酶表达显著下降,导致其TCA循环活动减弱。这种代谢差异带来了细胞内α-酮戊二酸及其相关代谢物水平的动态变化。α-酮戊二酸不仅是TCA循环中的关键代谢中间产物,也是许多依赖αKG的二氧化酶家族的必需辅因子。
该类酶广泛参与DNA和组蛋白的修饰过程,从而调控基因表达和细胞命运塑造。研究显示,分泌细胞谱系中αKG水平的上升促进了这些二氧化酶活性的提高,进而增强DNA的羟甲基化标记(5hmC),促进细胞向分泌表型分化。此外,通过在小鼠肠道干细胞和衍生谱系中敲低OGDH基因,研究团队发现,OGDH的减少导致αKG积累,推动干细胞向分泌谱系转化,而在吸收谱系中则因能量不足出现细胞周期停滞及细胞死亡。这一发现表明OGDH在不同细胞谱系中具有截然不同的功能依赖,反映了细胞代谢状态与命运选择的紧密耦合。进一步深入探讨HNF4转录因子如何结合OGDH启动子区域,调节OGDH的表达,说明转录网络和代谢通路的交互是维持肠道细胞功能和命运平衡的重要机制。代谢状态变化不仅影响细胞能量供应,也通过代谢信号介导表观遗传改造,进而影响基因表达网络,塑造细胞的命运走向。
此过程中αKG充当代谢和表观遗传修饰之间的桥梁,揭示代谢产物作为表观遗传调控因子的核心作用。对于肠道损伤及炎症如溃疡性结肠炎,组织修复的关键在于恢复受损干细胞和分泌细胞的数量及功能。研究表明,炎症导致OGDH表达异常升高,降低αKG水平,抑制分泌细胞补充,阻碍组织修复。通过基因敲减OGDH或补充细胞透膜型αKG分子,促进了分泌细胞的分化和扩增,显著促进了组织再生和炎症缓解。这为溃疡性结肠炎等疾病的代谢干预治疗开辟了新路径。该代谢途径对细胞分化和命运决定的调控不仅限于肠道,还可能普遍存在于其他多能干细胞和组织再生过程中。
代谢状态塑造细胞周期、增殖及分化动力学,影响干细胞的命运决定和组织稳态。针对代谢适应的调控手段为再生医学和肿瘤学领域提供了丰富的治疗靶点。未来研究需进一步揭示代谢产物如何精细调控特定表观遗传修饰酶的活性,解析代谢网络与转录调控的整合机制,同时评估代谢干预剂在临床治疗中的安全性与疗效。此外,开发高通量代谢组学与单细胞分析技术,将更全面描绘细胞代谢状态与命运轨迹的关联,推动精准再生医学的发展。综上所述,代谢适应作为细胞命运决定的重要驱动力,特别是TCA循环中OGDH及其代谢产物αKG的梯度调节,为肠道组织修复提供了新的生理机制和理论基础。通过整合代谢、转录及表观遗传调控,细胞能够根据环境和需求动态调整分化路径,实现组织稳态和损伤修复。
该机制的揭示不仅加深了我们对细胞生物学基本问题的理解,也为治疗炎症性肠病等临床难题提供了创新思路。未来代谢调控策略有望成为推动组织再生和功能恢复的重要支柱,开启精准医疗新时代。