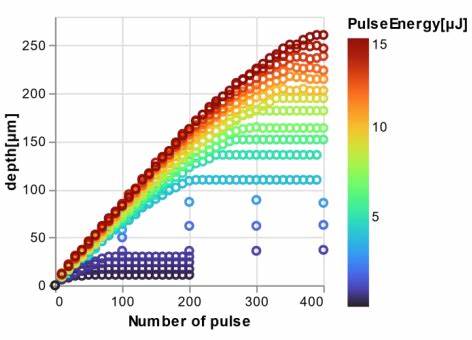
近年来,中国生物科技行业经历了前所未有的发展浪潮,已从一个相对封闭和区域性的市场,逐步迈向国际视野。伴随着国家监管制度的改革和与西方制药企业不断增强的合作关系,中国的生物科技公司正积极参与全球临床试验,推动其创新药物走向世界。然而,在这一进程中,这些企业也必须应对跨境物流复杂性、临床试验方案标准不一及沟通协调上的困难,才有可能在国际药物研发领域占据一席之地。中国正加速成为全球临床试验的核心力量。本土监管机构不断完善审批流程,缩短审评周期,尤其是在创新药物的审批中制定了更为快速与透明的机制。中国国家药品监督管理局(NMPA)发布的30天审批草案就是明显的例证。
这样的改革不仅提高了国内药品上市的速度,也使国际药企和合作伙伴对中国市场的信心显著增强。根据相关数据分析,中国在临床试验总量上已经超过美国,成为全球最大临床试验市场之一。这一崛起推动国内生命科学公司积极加速创新药物的研发进程,并吸引更多海外合作伙伴与投资。然而,尽管政策利好,运营层面的挑战依然不可忽视。跨境供应链管理成为许多首次涉足国际试验的中国企业面临的重要难题。以生物科技公司Brii Biosciences为例,国际贸易关税的提升大幅增加了临床试验药物进口成本,影响了试验执行的效率与预算安排。
由此可见,国际贸易环境的不稳定因素直接影响企业的财务和运营计划。此外,在临床方案设计与执行方面,文化差异和监管要求的差异给企业带来不小压力。不同国家对试验方案设计的要求、数据采集标准及伦理规范均存在较大差异。中国企业往往需要加强与海外合作方的沟通和协调,确保临床数据的质量与合规性能够达到国际认可的标准。对此,业内专家建议企业应尽早组建具备全球视野的临床团队,提前在项目启动阶段达成多方共识,降低执行过程中潜在的不确定性。国际合作的深化也掌握在如何有效融合本土优势与全球经验之上。
中国生物科技企业在国际舞台上的成功,既依赖于政策的支持,也离不开执行环节的细致打磨。面对多元监管体系与复杂的运营环境,坚持透明的沟通机制和严格的质量控制成为信任建立的基石。与此同时,技术创新也成为助力中国生物科技崛起的重要推动力。利用大数据、人工智能等现代信息技术优化临床试验设计和管理,提升数据分析效率,有效缩短药物研发周期,这些创新手段帮助企业更好适应国际竞争环境。随着全球临床试验网络的扩展,中国不仅为国际药企提供了丰富的患者资源和成本优势,也在推动本土创新药物走向全球市场。未来,随着监管环境的进一步统一和国际标准的持续融合,中国生物科技行业将具备更强的全球竞争力。
企业需要持续优化跨文化管理能力,加大对合规性的投入,并灵活应对国际市场的多变形势。总结来看,从一个国内市场走向全球舞台,中国生物科技企业正经历一次系统而深刻的转型。通过推动监管改革、提升运营能力、加强国际合作及技术创新,中国正不断突破临床试验的多重瓶颈,逐渐赢得国际社会的信赖与认可。随着这些趋势的持续发展,中国生物科技行业有望在全球医药创新格局中扮演更加重要的角色,引领未来医疗健康领域的变革新篇。 。