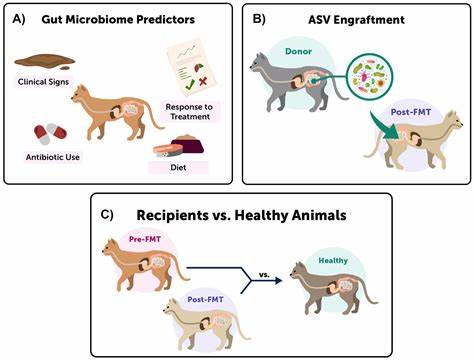
肠道微生物群在维持人体健康中扮演着关键角色,其多样性和功能完整性直接影响着免疫系统、新陈代谢以及整体健康状态。抗生素的广泛使用虽然能够有效治疗感染,但也不可避免地导致肠道菌群的严重紊乱和功能丧失,影响机体健康恢复。近年来,科学界对如何促进肠道微生物恢复的研究持续升温,传统的粪菌移植(FMT)被视为一种有效的干预方式。然而,近期一项发表于《Nature》的研究突破了这一认知,指出饮食调控在肠道微生物恢复中的作用远超微生物移植,为消除认知误区提供了科学依据。该研究通过小鼠模型,剖析了抗生素治疗后不同饮食习惯对肠道微生物群恢复的影响,揭示了饮食构成与微生物群互动的深层机制。 研究团队以正常饮食(常规饲料)和典型西方高脂低纤维饮食为变量,分析两组小鼠在经历抗生素处理后的肠道菌群恢复轨迹。
结果显示,常规饮食组的小鼠肠道微生物群恢复迅速,菌群多样性和功能代谢均趋于正常水平,而西方饮食组则表现出持久的菌群失调,菌群结构受损严重,功能丰富度下降明显。这种差异不仅体现在菌群组成上,更影响到肠道代谢产物的生成和免疫屏障的重建。 进一步的代谢模型分析揭示,在常规饮食环境中,肠道菌群形成了复杂的互利共生网络,即所谓的“交叉营养利用”(syntrophic cross-feeding),多个不同细菌种类协同利用食物中的复杂碳水化合物,产生多样的代谢产物,彼此依赖,共同维持生态稳定性。而在高脂低纤维饮食中,则出现单一优势菌群的局面,这些菌群快速消耗易得的养分资源,却几乎不释放能够支持其他菌群生存的次级代谢物,导致整个菌群生态系统极度单一和脆弱。 该研究还开展了干预实验,验证了饮食调整在促进微生物恢复中的决定性作用。当西方饮食组小鼠切换到富含纤维和多样化碳水化合物的饮食后,肠道菌群逐渐恢复多样性和功能,显示出较强的生态韧性。
相较之下,单纯通过粪菌移植尝试恢复肠道菌群的组别效果不佳,菌群恢复缓慢且不完全。由此提出,营养环境是驱动健康肠道微生物恢复的关键前提,而微生物移植无有效饮食支持,难以实现预期效果。 更令人关注的是,高脂低纤维饮食导致的持久性菌群失调使小鼠对肠道病原菌沙门氏菌(Salmonella enterica serovar Typhimurium)的易感性明显增加。这意味着饮食不仅影响微生物生态,还可能影响宿主的感染抵抗力和免疫屏障功能。肠道微生物通过竞争营养物质、调节局部环境和激活宿主免疫机制,共同防止致病菌的侵袭。饮食结构破坏这一平衡,带来新的健康风险。
这一系列发现对人类健康管理和疾病预防具有重要启示。传统依赖粪菌移植纠正微生物失调的方式,尤其在缺乏针对性的饮食干预时,疗效有限且可能带来潜在风险。而科学合理的膳食设计,通过提供丰富而多样的可发酵纤维,支持肠道益生菌的繁荣与代谢活动,从根本上促进菌群生态恢复与稳态保持。 当前西方社会普遍摄入高脂肪、低纤维饮食,伴随抗生素的广泛使用,肠道微生物群面临严峻挑战。现代生活节奏快,饮食习惯 Westernized 趋势明显,导致肠道菌群多样性下降,与肥胖、糖尿病、炎症性肠病及多种免疫疾病的发生息息相关。基于动物模型研究的这一成果,强调了饮食质量在微生物生态恢复中的核心地位,呼吁在临床干预中,必须将营养干预作为基础,配合必要的其他治疗手段,形成综合性的微生物群恢复策略。
此外,研究利用先进的基因组学和代谢组学技术,结合计算代谢建模,展现了微生物间复杂的代谢交互和协同作用。此类方法不仅深化了我们对肠道生态系统的理解,也为未来开发个性化营养方案和定向微生态疗法提供了强有力的工具。未来,结合宿主遗传背景、微生物群落特征和饮食习惯,量身定制饮食干预,有望实现更加精准和有效的肠道健康管理。 总之,饮食作为调控肠道微生物群的关键因素,对抗生素后微生态恢复发挥着不可替代的作用。合理调整饮食结构,增加膳食纤维和多样化营养成分,不仅有助于修复肠道微生态,更能增强机体的免疫防御和代谢健康。科学界和临床实践应充分重视饮食干预的基础地位,减少对微生物移植的依赖,推动肠道健康管理进入新的时代。
通过饮食驱动的微生态优化,将为预防和治疗多种相关疾病开辟崭新路径,为全民健康贡献可持续的解决方案。