艾滋病毒(HIV)在人类免疫系统中构建了复杂的潜伏储库,特别是在静止的CD4+ T细胞中形成的整合前病毒成为治愈HIV的重大障碍。尽管抗逆转录病毒治疗(ART)有效抑制了病毒复制,但其并不能根除潜伏病毒,休眠的病毒可以在停药后迅速激活,导致病毒反弹。近年来,科学家不断寻求能够特异性激活潜伏病毒,从而实现“激活并消除”(shock and kill)策略的潜伏逆转剂(LRAs)。然而传统的小分子LRAs往往存在效率低、非特异性和毒副作用等问题,亟需开发更精准高效的新型策略。脂质纳米颗粒(LNP)携带信使RNA(mRNA)的技术被誉为基因治疗和疫苗领域的革命,尤其在新冠疫情期间mRNA疫苗的成功使其应用前景更加光明。最新研究通过改良LNP配方,成功实现了高效向未激活的休眠CD4+ T细胞递送mRNA,为HIV潜伏逆转提供了全新途径。
传统LNP如patisiran类制剂向静止T细胞传递mRNA的效率极低,且需要T细胞预激活以提升转染率,这不仅增加细胞应激和毒性风险,也不利于实际疗法的推广。研究团队研发的LNP X配方基于SM-102阳离子脂质替代传统MC3,并引入β-谷甾醇替代胆固醇,这种独特组合极大提升了LNP与非激活T细胞的结合能力及细胞内mRNA释放效率。实验数据显示,使用LNP X递送编码荧光蛋白mRNA,休眠CD4+ T细胞的转染率可达76%以上,且细胞活力无明显下降,突破了过去的转染瓶颈。此外,LNP X可以同时传递较大且复杂的mRNA组合,如CRISPR-Cas9激活系统。该技术能够以较低的毒性激活针对HIV长末端重复序列(LTR)特异的转录,从而诱导病毒表达。HIV Tat蛋白作为病毒转录的关键激活因子,科学家将其编码mRNA封装于LNP X中,成功在实验室模型和患者来源休眠CD4+ T细胞中诱导了强烈的HIV基因转录激活。
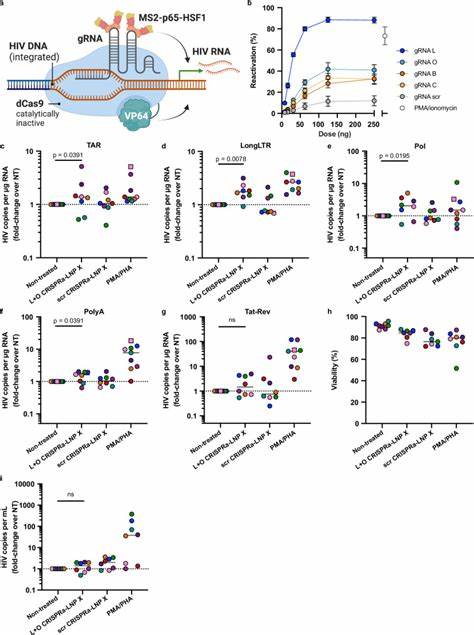
Tat-LNP X表现出超越传统激活方案(如PMA/PHA)的潜伏逆转能力,并且不会触发广泛的T细胞激活和炎症反应,有望减少副作用和免疫耗竭风险。利用数字PCR技术监测多种HIV转录阻断阶段,发现Tat-LNP X能够全面克服从转录启动到RNA剪接的多重障碍,促进成熟病毒RNA合成和病毒颗粒释放。然而,尽管Tat-LNP X显著提升病毒转录,但未在短期内导致整合病毒DNA数量的显著减少,提示需要与杀伤效应增强或促凋亡药物联合使用,实现潜伏细胞真正清除。CRISPR激活(CRISPRa)技术通过利用去切割活性的Cas9蛋白结合转录激活模块,实现对特定基因的精确激活。针对HIV LTR区域设计的向导RNA与LNP X结合递送,能够特异性诱导潜伏病毒转录,减小对宿主基因表达的影响。实验中,以LNP X递送组合dCas9-VP64、MS2-p65-HSF1激活蛋白及特定引导RNA,在患者CD4+ T细胞中诱导了HIV转录,但激活强度稍逊于Tat-LNP X,且未观察到毒性和非特异激活。
进一步优化CRISPRa递送方案和引导RNA设计,有望提升其临床应用前景。LNP X的制备采用精准的纳米流控混合技术,确保粒径均一、载药效率高且可重复性良好。其粒径大小适合细胞摄取,且表面组分优化助力于细胞膜结合和内吞过程。机制研究显示,LNP X的优势部分源于增强的细胞表面结合和胞内mRNA翻译效率,而非单纯提升内体逃逸能力,揭示了mRNA治疗载体设计的新思路。此项技术不仅对HIV潜伏逆转意义深远,也为免疫治疗、基因编辑及疫苗输送开辟新路径。未来,结合针对性的免疫清除策略、细胞特异性靶向改造及长期体内安全性评估,将推动mRNA-LNP基因疗法实现临床应用。
全面的多组学分析亦可帮助评估潜伏细胞中的转录及代谢变化,揭示潜伏逆转后病毒清除的瓶颈。总体而言,创新的LNP X递送系统实现了对休眠T细胞的高效非激活性mRNA传递,突破了传统LNP载体的局限。Tat蛋白和CRISPRa激活剂的成功应用印证了该平台激活潜伏HIV的巨大潜力,为研发高效低毒的新一代HIV治疗方案奠定基础。展望未来,基于mRNA-LNP的精准基因调控将成为复杂疾病治疗的有力武器,加速实现HIV功能性治愈乃至根治的目标。