镰状细胞贫血和β地中海贫血是两类影响全球数百万人的单基因遗传性血红蛋白病。随着基因编辑技术的成熟,尤其是CRISPR/Cas9及其衍生工具的崛起,这些长期被视为慢性、终生管理疾病的病症,正进入可实现功能性治愈或长期缓解的时代。彻底理解这些技术路径、临床证据以及伴随的伦理和经济挑战,对于患者、临床医生与政策制定者都至关重要。 首先,需要回到疾病本身。镰状细胞贫血由HBB基因中的单一碱基突变引发,导致红细胞内血红蛋白异常构象,易形成镰刀状,从而引发血管阻塞、慢性溶血与多器官损害。β地中海贫血则常由HBB基因丢失或功能下降导致成人血红蛋白生成不足,严重者依赖终生输血并面临铁负荷并发症。
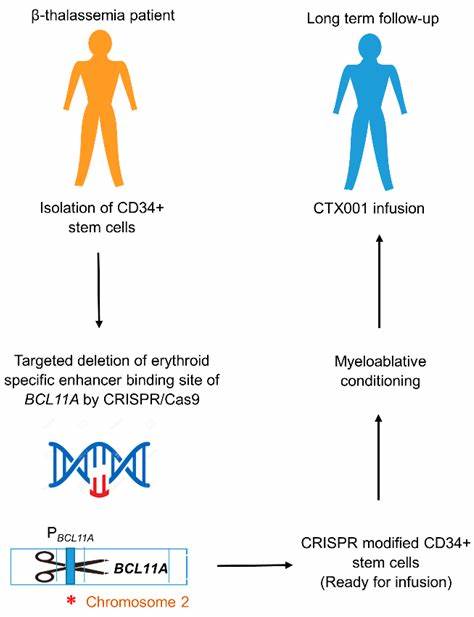
临床观察还显示,仍保有高水平胎儿血红蛋白(HbF)的患者,其病情通常明显轻微,这一现象为基因疗法提供了重要切入点。 CRISPR/Cas9技术在血液病领域的应用主要有两条思路:直接纠正病变HBB基因或通过调控基因网络恢复HbF表达。直接纠正需要在造血干细胞中精确替换或修复突变序列,这一方案从理论上最为根本,但在效率、精准性与潜在染色体重排风险上面临技术挑战。相对而言,另一条更为实用的路径是靶向负责抑制HbF的调控因子,例如在红系细胞中特异性降低BCL11A的表达或破坏其红细胞增强子,从而诱导成人患者重新表达胎儿血红蛋白,缓解病理性症状。 临床试验数据显示,基于BCL11A增强子编辑的自体造血干细胞治疗已经在若干患者中取得显著疗效,不少镰状细胞患者实现了疼痛危机的消失或显著减少,重度β地中海贫血患者也在停用定期输血后保持稳定血红蛋白水平。这类离体(ex vivo)编辑流程通常包括采集患者的CD34+造血干细胞,体外用编辑试剂处理,经过质量检测后回输至经预处理破坏部分骨髓的患者体内。
尽管疗效令人鼓舞,整个流程涉及化疗样的预处理、复杂的细胞制造和长期随访,造价和并发症风险不容忽视。 近年来,碱基编辑和prime编辑等"无双链断裂"策略成为降低潜在风险的关键方向。碱基编辑器可以在不产生双链断裂的情况下将单个碱基转换为目标碱基,用于纠正特定的点突变或模拟有益的调控变体。prime编辑则可以实现更复杂的插入、删除或替换,对某些复杂突变具有更大的适用性。这些方法在初步临床数据和早期研究中显示出诱人的安全性与有效性,但同样面临将编辑工具高效、安全地递送至造血干细胞、以及识别极其罕见脱靶效应的挑战。 关于安全性,必须强调长期随访的重要性。
离体编辑虽然允许在回输前对细胞进行质量检测,但低频率的脱靶事件、复杂的染色体重排或潜在的基因激活效应可能在数年后才显现。监管机构因此要求系统性的不良事件登记与长期随访计划,以便捕捉罕见但严重的后果。此外,预处理方案本身的毒性,尤其是对儿童或身体虚弱患者的限制,仍是临床推广的一大障碍。 在技术之外,社会经济与伦理问题同样复杂。当前一系列基因编辑疗法的成本高昂,从细胞采集、制造到住院与随访,几乎都需要高度专业化的设施与团队,这使得这些疗法在资源有限的地区难以普及。与此同时,镰状细胞病在非洲、南美洲以及某些亚洲地区的患病率较高,如何在全球范围内实现公平可及性,是科学家和政策制定者必须面对的问题。
伦理讨论涉及治疗的分配、公平性以及代际影响。虽然多数基因编辑针对的是体细胞,理论上不会改变生殖系,但仍有关于资源分配的道德辩论:是否应优先为那些能从一次性高成本治疗中受益的个体投入大量资源,而不是将资金用于更广泛的公共卫生或预防项目。这类问题需要跨学科的评估,包括健康经济学、患者社区参与与公共政策的平衡。 未来研发方向呈现多样化。一方面,优化离体编辑流程、提高编辑效率并简化制造,是短期内扩大适用人群的关键。另一方面,开发体内(in vivo)递送策略,旨在直接将编辑工具注入患者体内以在原位修改造血细胞,将从根本上降低成本与复杂性,但必须克服递送靶向性、免疫反应与脱靶控制的重大难题。
病毒载体、脂质纳米颗粒以及新的蛋白工程递送方法都在积极探索之中。 监管与市场路径也将影响这一领域的走向。不同国家对基因治疗的审批标准、支付机制与长期安全监管各不相同。若要在全球范围内实现公平可及,需要创新的支付模式,例如基于效果的分期付款、公共与私营部门的合作计划以及在低收入国家建立本地化制造与治疗中心。 科学研究层面,比较不同策略的长期疗效和安全性将成为重要课题。直接修复HBB与反向激活HbF路径各有优劣,前者更具根治性但技术门槛高,后者在临床证明中速度较快且更易实施。
系统性的队列比较研究和跨中心数据共享将帮助明确在不同患者群体中的最优策略,例如基于特定基因型、年龄或合并症决定个体化治疗方案。 患者声音与社会参与也不容忽视。由患者社区参与的研究优先级设定、伦理审查与获益共享机制,有助于确保研究方向与临床应用真正回应患者的需求,避免科研与商业利益主导下的偏差。教育与咨询也必须跟上技术进展,帮助患者理解风险、长期监测需求以及潜在的替代方案。 总结而言,CRISPR及其衍生技术正在重塑对镰状细胞贫血与β地中海贫血的治疗前景。从科学原理到临床实践,从短期疗效到长期安全,从技术创新到公平分配,每一步都充满机遇与挑战。
要将实验室的希望转化为广泛可及的临床现实,需要在技术研发、监管框架、伦理讨论与全球卫生政策上协同推进。未来若能实现高效、安全且可负担的基因编辑治疗,将为数百万患者带来真正的生活质量转变,也将为其他单基因疾病的治愈树立重要范例。 。