癌症转移是癌症患者死亡的主要原因之一,其复杂的生物学过程和多变的微环境一直困扰着医学界的治疗难题。传统的抗癌疗法通常侧重于切除和控制原发肿瘤,但对转移灶的靶向能力有限,导致许多患者在早期治疗后仍面临复发和远处转移的困境。近年来,随着纳米医学技术的迅猛发展,利用纳米载体实现对转移癌细胞及其微环境的精准打击,成为抗癌研究的新焦点。纳米医学不仅能提高药物的靶向性和生物利用度,还能突破生物屏障,实现对转移癌症全过程的干预,为临床带来新的治疗策略和希望。纳米技术在抗转移癌症中的应用,核心在于其独特的物理化学性质。纳米颗粒的尺寸范围通常介于1到100纳米之间,这种微观尺度使它们具备优异的体内穿透能力及表面修饰潜力。
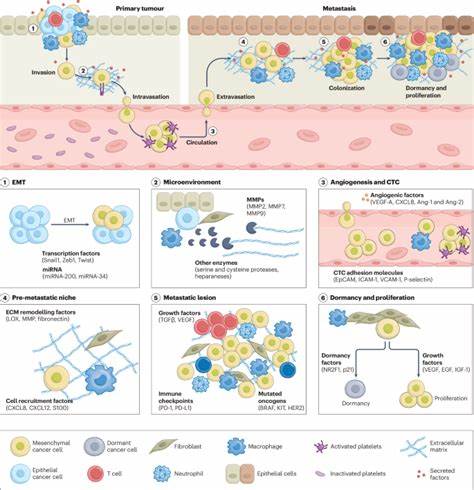
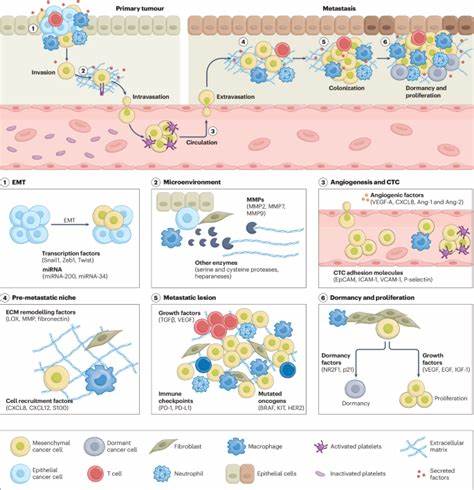
研究者通过设计不同形态和功能的纳米载体,比如脂质体、聚合物纳米粒子、金属纳米颗粒等,结合肿瘤特异性分子标签,实现了对癌细胞和肿瘤微环境的有效识别和精准定位。癌症转移经历了一系列复杂步骤,包括原发肿瘤细胞的脱离、局部侵袭、血管内侵入(内皮穿透)、进入循环系统、生存、离开血管(外渗)以及在远处器官的定植和生长。每一个步骤都为纳米治疗策略提供了独特的靶点和切入点。纳米载体可以携带化疗药物、基因编辑工具、免疫调节分子等多种治疗物质,针对癌细胞转移过程中关键的信号通路和微环境因素进行干预。对肿瘤微环境的调控尤为关键。肿瘤转移的发生不仅依赖于癌细胞自身,还与其周围的基质细胞、免疫细胞及血管网络密切相关。
利用纳米技术,研究人员可以调节肿瘤间质的刚性、血管的通透性,甚至逆转局部免疫抑制状态,从而为药物和免疫细胞的有效渗透创造条件。纳米载体的智能化设计也日益成熟。通过刺激响应型材料,纳米颗粒能够根据肿瘤局部的酸性、酶活性或外部光、热等信号触发药物释放,实现治疗的时空精准控制,显著提升疗效并降低全身毒性。此外,对于转移性癌症治疗中经常面临的多药耐药问题,纳米医学通过联合药物递送和基因沉默技术,充分发挥协同作用,克服癌细胞的耐药机制。RNA干扰和CRISPR基因编辑技术的引入,使得治疗不仅停留在细胞死亡层面,更是从分子水平调整和抑制癌细胞的转移潜能。免疫治疗已成为现代癌症治疗的重要手段,纳米医学则为其提供了强力助推。
纳米颗粒可以被设计成纳米疫苗,载运肿瘤特异性抗原,激活患者自身免疫系统,促进对转移癌细胞的清除。更有研究将纳米载体与免疫检查点抑制剂结合,形成复合疗法,有效激活沉睡的免疫反应,增强抗癌持久性。此外,纳米技术还能辅助细胞治疗,如CAR-T细胞,改善其在肿瘤微环境中的存活和功能,使免疫细胞能够克服转移癌的复杂防御机制。在临床转化层面,目前已有多种抗转移的纳米药物获得批准,更多的纳米医疗产品正处于临床试验阶段。研究不仅关注单一药物的疗效,更强调患者的异质性和个性化治疗,借助纳米技术实现精准医疗的目标。通过有效的患者分层和生物标志物筛选,优化纳米药物的给药方案,提升治疗响应率。
然而,纳米医学在转移癌治疗中的挑战也不容忽视。纳米颗粒在体内的分布和代谢复杂多变,如何避免非特异性聚集、降低潜在的毒性副作用,依然是研究者努力的方向。同时,跨越生物屏障、实现良好体内稳定性和靶向性、解决大规模生产的工艺难题,都是推动这一领域发展的关键瓶颈。未来,随着多学科交叉融合,纳米医学与基因组学、免疫学、材料科学、人工智能等领域的结合,将进一步深化对转移机制的理解和精准干预。新型智能纳米载体的开发、微环境定向的调控策略以及个体化联合用药方案的优化,将推动转移癌症治疗进入一个崭新的时代。总体而言,纳米医学为癌症转移的治疗提供了创新的视角和技术手段。
它不仅能有效改善药物输送效率,减少副作用,还能够针对转移过程中各个关键步骤进行多层次打击,从而提升转移癌症患者的生存率和生活质量。随着研究的深化和技术的提升,纳米医学将在抗转移癌症领域发挥更加重要的作用,成为实现精准、高效、个性化癌症治疗的重要利器。 。