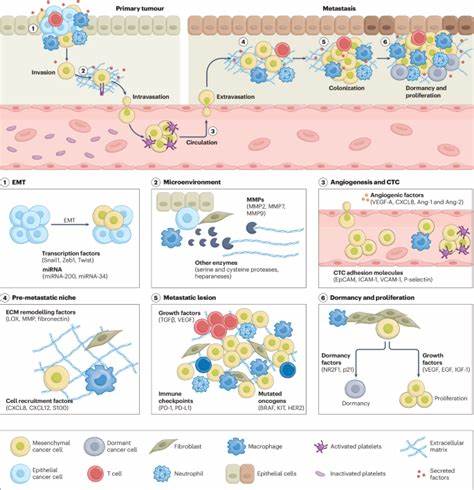
癌症转移是癌症患者面临的最大挑战之一,也是导致癌症高死亡率的重要原因。传统治疗方法往往主要针对原发肿瘤,难以有效控制和消除已经扩散到其他组织和器官的转移灶。近年来,纳米医学作为一种结合纳米技术与医学的前沿领域,凭借其独特的物理化学性质和靶向能力,为转移癌症的治疗提供了崭新的思路和工具。 纳米医学的核心优势在于纳米载体能够精准携带药物,绕过生物屏障,增强药物在肿瘤组织中的积累和释放,从而提升治疗效果并减少对健康组织的副作用。尤其是在转移癌治疗中,纳米粒子可以设计成靶向转移过程中的关键环节,包括癌细胞的侵袭、进入血管(血管内转移)、循环、离开血管(血管外转移)以及在新环境中生存和定植。 癌症转移的过程被称为"转移级联",包含多个环节,每个环节都为纳米医学提供了潜在的靶点。
首先,癌细胞通过上皮-间质转化(EMT)获得侵袭能力,脱离原发肿瘤。纳米载体可以携带针对EMT相关信号通路的药物或基因治疗分子,阻断癌细胞的迁移能力。随后,癌细胞需穿过血管壁进入循环系统,纳米颗粒能够调控肿瘤微环境中的血管渗透性,提高药物在转移部位的精准投放。 在血液中循环的癌细胞面临免疫细胞的攻击和血流的剪切力,纳米医学策略通过设计能够识别循环肿瘤细胞特异性标志物的纳米颗粒,实现对这些稀有细胞的精确捕获和杀伤。一些纳米平台甚至可以结合光热、放射性治疗,协同提高对转移细胞的治疗效能。此外,循环肿瘤细胞往往以集群形式存在,纳米技术亦能针对其特有的细胞间粘附分子进行干预,阻止转移灶的形成。
转移癌细胞到达新环境后,需在异地的微环境中"扎根"并生长。纳米医学还关注肿瘤微环境的调控,利用纳米药物载体实现肿瘤基质重塑、免疫调节和血管正常化等手段,破坏有利于转移癌细胞生存的"预转移生态位",遏制转移的进程。例如,通过靶向基质蛋白酶或促进免疫细胞活性,纳米技术为转移灶的控制提供了新的路径。 值得一提的是,当前已有多款经过临床验证的抗转移纳米药物被批准使用,同时超过二十个相关的临床试验正在进行。纳米医学的设计不断朝着智能化、多功能化方向发展,包括刺激响应型载体、主动靶向系统、核酸递送和纳米免疫疗法等。这些创新设计有望克服传统药物的局限,提升治疗的专一性和疗效。
纳米递送系统的刺激响应性使其能够根据肿瘤局部的pH值、酶活性或温度等生理环境,实现药物的精准释放,最大化地攻击癌细胞而保护正常组织。多药协同输送方案则通过联合不同机制的药物,减少耐药性的产生,同时抑制转移的多个环节。核酸药物如siRNA和mRNA的纳米递送技术极大地拓展了对癌症基因调控的干预能力,促进个性化精准治疗的发展。 免疫疗法作为抗癌的新兴领域,与纳米医学的结合进一步增强了对转移癌的治疗潜力。纳米载体不仅可用于递送免疫调节剂,还能作为免疫原性死亡的触发器,激活机体免疫系统对肿瘤的识别和攻击。此外,纳米技术支持的癌症疫苗和CAR-T细胞疗法也在临床和预临床研究中表现出积极的成果。
预临床模型的构建是纳米抗转移药物研发的重要环节。包括体外细胞模型、三维肿瘤模型以及多种动物模型,这些平台在真实模拟转移过程和测试药物效果上各有优势。新兴的器官芯片和人源化模型正在成为桥梁,提升转化医学的准确性和可靠性。 未来,患者分层将在纳米抗转移药物的临床应用中发挥关键作用。通过基因组学、生物标志物和影像学技术,精准识别患者肿瘤的转移特征和纳米药物响应性,实现个体化治疗方案,将提升治疗成功率并减少不必要的副作用。 总体来看,纳米医学为攻克癌症转移提供了前所未有的工具和方法。
从设计到应用,从分子机制到临床转化,纳米技术正推动着癌症治疗进入一个更加精准、高效和智能的新时代。面对转移癌带来的巨大医疗挑战,纳米医学有望成为开启新希望的重要钥匙,造福广大患者和社会。 。