骨折作为常见的临床骨科问题,尤其在复杂或严重的骨折治疗中,传统治疗方法面临一定局限。随着医学技术的发展,科学家们致力于寻找能够加速骨组织再生、提高治疗效率的创新方案。近年来,宾夕法尼亚州立大学的生物医学工程团队研发出一种名为CitraBoneQMg的植入式可降解骨骼支架,融合了镁、谷氨酰胺和柠檬酸三种天然分子,显著促进骨折部位的骨细胞生长与修复,为骨折患者带来了福音。 传统骨折治疗多数依赖外固定装置如石膏或支架,以保持骨骼位置稳定,辅助自然愈合。但在复杂骨折的情况下,单纯依靠体外固定无法确保骨细胞有效生长,往往需要外科手术植入骨移植物或金属固定器。然而,这些材料可能存在排异风险,且无法主动促进细胞代谢和骨组织再生。
相比之下,CitraBoneQMg利用可降解高分子材料构建骨骼支架,不仅安全性高,还能通过释放镁离子和谷氨酰胺直接激发骨细胞能量代谢,增强细胞的分化与增殖能力。 镁作为人体内重要的微量元素,参与多种生理功能,包括骨质生成和能量代谢。谷氨酰胺是一种重要氨基酸,能够为细胞提供能量并参与蛋白质合成。柠檬酸则是三羧酸循环的关键中间体,支持细胞的基础代谢过程。该团队创新地将这三种分子融合到支架材料中,实现了协同作用,显著提升骨细胞的能源供应,激活AMPK和mTORC1两种关键能量调控通路。传统情况下一条通路启动时另一条放缓形成平衡,而CitraBoneQMg支架使两条通路同步提升,犹如为骨细胞"充电",促进其迅速分化为骨细胞,加快骨组织的形成和修复。
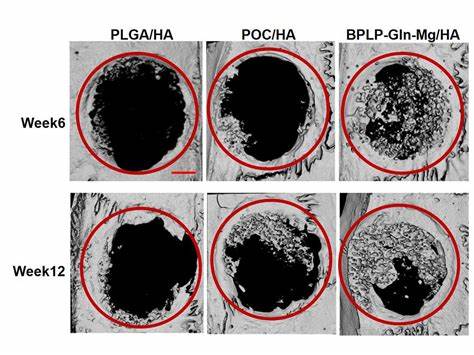
生物相容性是植入材料的重要指标。CitraBoneQMg源于FDA已批准的柠檬酸基材料,结合天然发生的镁和谷氨酰胺,确保材料不会引发排斥反应。同时,该支架具有可降解性,随着骨骼修复进程逐渐被人体吸收和替代,避免长期外来物残留带来的风险。此外,研究发现此支架材料还具备天然的光致发光和光声效应,可以通过超声波等无创手段进行体内成像,方便医生实时监测植入物在体内的降解和骨愈合状态,大幅提升临床应用的便利性和安全性。 在实验验证阶段,研究者将CitraBoneQMg植入大鼠颅骨缺损处,经过12周的观察,对比普通柠檬酸基支架及传统骨材料的恢复效果。结果显示,CitraBoneQMg组骨骼生长面积较传统支架增加了56%,较传统骨材料更是提高了185%,体现出其强大的骨组织再生促进能力。
此外,植入区域还观察到神经再生和明显的抗炎反应,为骨折的长期稳定愈合奠定基础,减少感染及炎症并发症的风险。 与口服补充营养素不同,CitraBoneQMg通过局部植入将活性分子直达骨折处,提高营养物质利用率,有效避免系统吸收后难以到达患处的问题,提升骨细胞的能量供给和代谢效率。该研究开创了生物降解骨修复材料的创新应用方向,推动骨折治疗从被动支撑走向主动促进细胞再生,赋予骨组织自我修复的生命力。 展望未来,随着生物工程与再生医学的发展,类似的多功能支架材料将在临床骨科发挥越来越重要的作用。结合纳米技术、智能监测和精准药物输送,骨修复材料将实现个性化定制及动态调节,为患者带来更短的康复时间和更优的疗效。科研团队也计划结合3D打印技术,打造符合不同骨折部位需求的支架结构,提高植入的适配性和功能性。
在骨科治疗过程中,神经再生与抗炎反应同样关键,它们保障受损组织的健康环境,避免继发神经损伤和慢性炎症,这些效应使得CitraBoneQMg优势更为显著,代表了骨折治疗的整体优化思路。未来结合临床大规模试验的开展,期待该技术在更多患者身上验证其安全性和疗效,早日推广应用。 总的来看,CitraBoneQMg可降解骨骼支架通过科学设计实现了材料、营养与细胞能量代谢的完美结合,极大加速了骨折愈合过程,为传统骨折治疗注入了活力与创新。它不仅改善了患者的治疗体验和康复效果,也推动了生物医学工程与骨科领域的深度融合与发展,开启了一条更加智能、高效的骨修复新时代。随着相关技术不断成熟,未来骨折患者将有望享受更加精准、安全和快速的治疗方案,真正实现医疗科技造福人类健康的理想。宾夕法尼亚州立大学团队的这项突破性研究无疑是该领域的重要里程碑,也彰显了跨学科合作在医学创新中的巨大潜力。
。