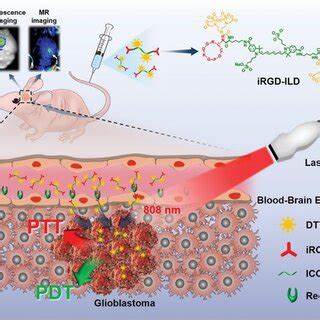
胶质母细胞瘤(glioblastoma,GBM)是神经系统中最为严重和难以治疗的恶性肿瘤之一。其高度恶性、侵袭性强以及边界模糊,给传统手术切除带来了极大的挑战。肿瘤残留常导致患者复发和预后不良。因此,在脑肿瘤外科领域,开发能够精准识别肿瘤边界、提高手术切除完整性的技术,成为当务之急。近年来,近红外脂肪酸分子探针在胶质母细胞瘤图像引导手术中的应用,展现出巨大的潜力和广阔的前景。脂肪酸代谢重编程是肿瘤细胞的一大特征,尤其是在胶质母细胞瘤中,异常的脂肪酸吸收与合成为其高速增殖和侵袭能力提供了强有力的代谢保障。
传统对脂肪酸代谢的研究多依赖放射性示踪剂,虽然敏感但存在放射性损伤、设备复杂和成本高昂等限制,难以广泛用于临床手术现场的实时成像。随着光学成像技术的进步,尤其是近红外(NIR)成像因其穿透深、背景低和信噪比高,成为非侵入性肿瘤生物标志物检测的理想选择。在此背景下,通过将长链脂肪酸与临床已批准的近红外染料吲哚菁绿(ICG)共价结合形成的FA-ICG探针,提供了一种能够精准标记肿瘤脂肪酸代谢活跃区域的全新手段。FA-ICG利用肿瘤对脂肪酸的高摄取特性,实现选择性富集于肿瘤组织,结合ICG优异的近红外光学性质,成为实时、非侵入性、深层组织成像的有效工具。临床应用方面,FA-ICG探针能帮助外科医生在手术过程中准确识别并切除肿瘤组织,降低正常脑组织损伤风险,最大限度提高患者生存率。实验数据验证,在大鼠和人源性异种移植模型中,FA-ICG探针显示出优异的肿瘤特异性积累,肿瘤与正常组织的信噪比显著提升。
与未修饰的ICG相比,FA-ICG在术中图像引导下能够提供更加明确和持久的荧光信号,易于定位肿瘤边界,为手术导航提供有力支持。除此之外,FA-ICG探针还在伴侣动物犬只的皮肤肿瘤切除手术中展现出良好的成像效果,表明其跨物种的应用潜力和广泛的临床翻译价值。该技术的优势不仅仅在于高灵敏度和高选择性,还表现在其临床兼容性强。由于ICG已获FDA批准,相关的近红外成像设备也广泛应用于手术室,FA-ICG探针的引入几乎无需对现有设备做大的改动,方便快速推广。另一方面,FA-ICG对肿瘤脂肪酸代谢的靶向机制也为个体化治疗和术后疗效监测提供了可能。未来,该探针还可以与脂肪酸代谢抑制剂等靶向治疗策略结合,实现诊疗一体化,开拓肿瘤代谢影像引导精准治疗的新范式。
虽然应用前景广泛,FA-ICG作为一种新型分子探针仍需面对诸多挑战和优化空间。在药代动力学及安全性的深入研究中,必须保障探针的生物兼容性和快速代谢,减少对人体的潜在毒性和免疫反应。同时,针对不同肿瘤类型的脂肪酸摄取差异,需要设计更多种类的脂肪酸探针以覆盖更广泛的适应症。光学成像的空间分辨率与深度渗透能力也受限于目前技术,结合多模态成像手段,如磁共振成像(MRI)和PET的优势,有望克服单一成像手段的局限,为临床提供更加全面精准的肿瘤评估。从研究方法上看,FA-ICG探针的成功设计基于对脂肪酸转运蛋白的生物学深入理解和对ICG光学性质的精确调控。通过科学合理的化学合成技术,保证探针的稳定性和功能性,使其能够精准模拟天然脂肪酸进入细胞的路径,并在肿瘤细胞中实现有效捕获。
细胞实验验证了该探针在脂肪细胞和多种肿瘤细胞中的摄取特点,并通过脂肪酸竞争实验进一步证明了特异性。动物模型实验充分展示了FA-ICG在活体内的动态分布和肿瘤靶向能力,以及与传统染料相比的显著优势。现阶段,学界和产业界对基于代谢特征的分子探针寄予厚望,FA-ICG代表了这一方向的典范。结合同步研发的近红外成像设备和手术导航技术,图像引导手术正在逐步突破传统经验性手术的局限,迈向精准精准与可视化。展望未来,随着分子探针合成与分子影像技术的不断进阶,结合人工智能辅助图像分析,FA-ICG等新型探针将在脑肿瘤甚至更多癌症领域实现广泛应用,助力临床医生实现高效、低风险的精准治疗。同时,它也为肿瘤代谢机制的研究提供了直观、动态的成像平台,加速新药物开发与疗效评估。
总结而言,近红外脂肪酸分子探针FA-ICG在胶质母细胞瘤图像引导手术中发挥着重要作用。其基于脂肪酸代谢特异性靶向设计,结合近红外成像高灵敏度与深层穿透优势,成功实现了肿瘤的精准检测和导航切除,具有广阔的临床应用前景。未来通过技术优化和临床验证,必将推动脑肿瘤外科手术向更高水平迈进,为患者带来更大的生存获益和生活质量提升。