艾滋病病毒(HIV)的潜伏感染是至今阻碍该疾病彻底根除的主要障碍。潜伏阶段的HIV被整合进宿主静止状态的CD4+T细胞基因组之中,处于转录沉默状态,躲过了免疫系统和抗逆转录病毒治疗(ART)的监视与清除。虽然ART能够有效抑制活跃病毒复制,降低发病率和死亡率,但病毒潜伏库的存在要求患者必须终身服药,因此寻找能激活潜伏病毒,从而消除病毒储存库的策略成为研究的核心方向。近年来,mRNA与脂质纳米颗粒(LNP)技术的进步为基因治疗铺平了道路。LNP作为载体能够安全高效地将核酸序列递送至细胞内,实现基因表达的调控。尤其是在新冠疫苗中应用的mRNA-LNP技术,证明了其临床推广的可行性与安全性。
针对HIV潜伏病毒的激活,传统的小分子激活剂(LRA)存在诸多限制,诸如非特异性激活导致免疫细胞功能受损,或难以克服病毒转录从起始至剪接的多重阻碍。针对这一问题,科学家们研发了基于核酸的特异性激活手段,其中包括基于HIV转录激活蛋白Tat的mRNA递送和CRISPR激活系统(CRISPRa)。然而,困扰以往研究的是静止CD4+T细胞难以被有效转染,传统递送系统难以实现高效mRNA传递。正是在这一背景下,最新研究团队开发出一种全新的LNP配方,被命名为LNP X,成功实现了无需T细胞预激活即可高效递送mRNA至静止CD4+T细胞,且不引发细胞毒性和非特异性激活。LNP X融合了SM-102作为阳离子脂质与植物性类固醇β-谷甾醇组成,优化了纳米粒子的细胞结合和细胞内表达效率,显示出比FDA批准的类似平台高出数倍的转染效率。实验中将编码HIV Tat蛋白的mRNA封装至LNP X内,结果表明该系统在艾滋病毒感染者的外周血CD4+T细胞中强力激活了病毒基因转录,翻转了潜伏状态。
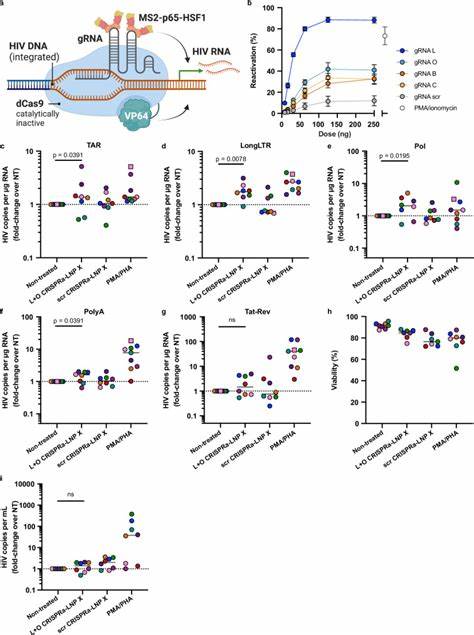
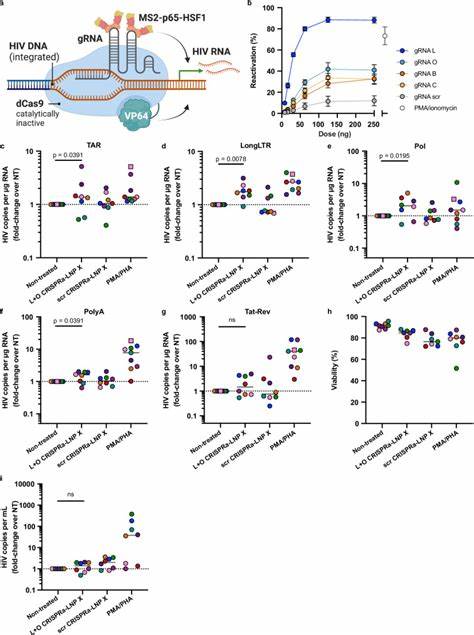
不同于以往的激活策略,Tat-LNP X不仅提升了潜伏病毒RNA的起始转录,也有效克服了转录伸长、剪接等多个步骤的障碍,促进了病毒活性基因的表达,却没有引起T细胞的全局激活,避免了对免疫系统的副作用。此外,LNP X还能封装更为复杂的CRISPRa系统,递送dCas9-VP64融合转录激活因子、MS2-p65-HSF1激活复合体及引导RNA,实现精准调控HIV LTR启动子区的病毒转录。通过这种策略,研究者实现了对HIV特异性基因的激活,进一步凸显LNP X在精准基因编辑及病毒激活中的潜力。尽管CRISPRa-LNP X激活潜伏病毒的效率略低于Tat-LNP X,但它的高度特异性和较低的脱靶效应使其成为下一代潜伏激活剂的理想候选。当前研究也揭示,单一的病毒激活或许尚不足以实现潜伏病毒的根除,病毒感染细胞的存活机制和免疫逃逸机制仍需结合细胞凋亡敏感剂及免疫增强剂配合进一步剖析和攻克。LNP X技术为种种潜伏激活手段的有效递送带来了新的突破,甚至在未来有望用于体内基因编辑或免疫治疗的直接应用。
其安全性和高效性提示,可以减少对高剂量系统性激活药物的依赖,降低全身性副作用和免疫系统损伤。未来研究需进一步开展体内生物分布、免疫原性及剂量安全性试验,同时探索如何将LNP X定向靶向CD4+T细胞以提升治疗特异性。该技术的多重潜力不仅有助于革新艾滋病治疗,更为其他免疫疾病和T细胞相关治疗带来希望。总体而言,LNP X结合mRNA表达的HIV Tat和CRISPR激活系统,展现了免疫学和纳米医学跨学科交汇的力量,有望推动艾滋病治愈研究翻开新篇章。在未来的临床应用中,这种安全、有效、特异性高的基因递送系统将极大地促进潜伏病毒的激活与清除,缩小病毒储存库,最终实现患者免疫系统自主控制甚至治愈。随着基因治疗和纳米技术的协同发展,mRNA-LNP用于潜伏激活的研究有望成为对抗艾滋病病毒关键的转折点。
期待科学家们继续优化这一平台,克服现有挑战,开启艾滋病根治的新时代。