HIV潜伏感染一直是艾滋病治愈研究中的核心难题。尽管抗逆转录病毒治疗(ART)能有效抑制病毒复制,延长患者寿命,但因病毒在静息CD4+ T细胞中以整合型沉默状态存在,一旦停止用药,病毒极易重新激活,造成病毒负荷复燃。这一隐秘病毒库即潜伏库,至今尚无完全清除手段,因此科学家们将目光聚焦于如何有效逆转病毒的潜伏状态,从而实现体内病毒根除。近年来,mRNA结合脂质纳米颗粒技术的发展,为基因治疗和病毒潜伏状态的激活提供了崭新工具。创新的LNP载体不仅能提升mRNA的传递效率,同时显著降低细胞毒性,使其在困难的静息T细胞中实现高效基因表达成为可能。传统的基因传递方式如病毒载体或电穿孔等对静息T细胞适用性不佳,且常伴随免疫激活或细胞损伤。
而利用LNP递送编码HIV特异性激活蛋白的mRNA,直接诱导病毒转录激活,避免了非特异性免疫激活,从根本上克服了此类技术瓶颈。科学家通过细致优化脂质成分,将离子化脂质从早期的DLin-MC3-DMA替换为增强胞内释放效率的SM-102,并用β-谷甾醇代替传统胆固醇,实现了LNP X这一高效配方。该配方在未经刺激的静息CD4+ T细胞中实现了超过75%的转染效率,且细胞活力无明显下降,证明了其卓越的生物相容性和传递能力。通过内源表达HIV的Tat蛋白,LNP X能显著促进病毒LTR区的转录延伸,激活潜伏病毒。Tat蛋白作为HIV转录的重要调控因子,能加强转录复合体对病毒基因组的结合,驱动病毒基因的表达。这一策略在体外静息T细胞模型和来自接受ART抑制治疗的艾滋病患者的外周CD4+ T细胞中均表现出强大效果,诱导多重病毒转录及剪接,促进病毒粒子释放而不引起T细胞的全局激活,降低潜在免疫副作用风险。
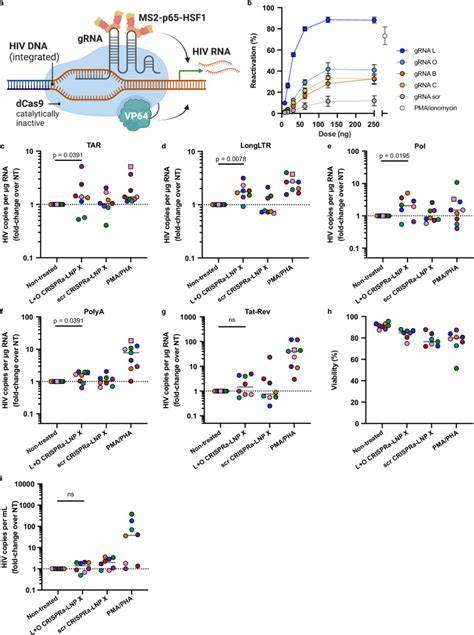
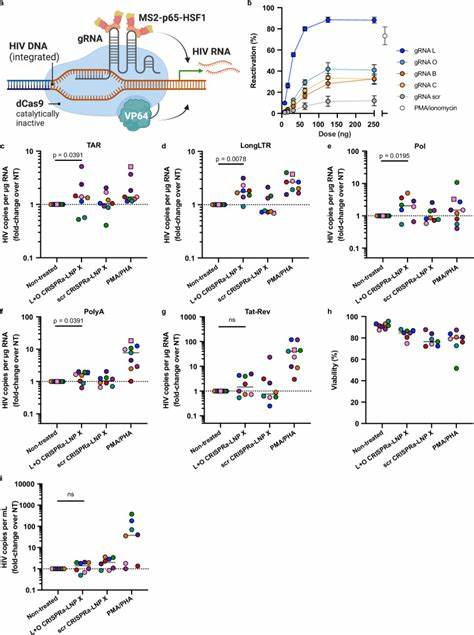
除Tat蛋白,研究团队还探索了使用CRISPRa系统特异性激活HIV病毒基因的可能。采用无切割活性的dCas9融合转录激活域,辅以MS2-p65-HSF1多功能激活子,通过靶向病毒LTR启动子区域的导向RNA实现精准调控。这一多组分RNA被共同包裹于LNP X中,首次实现了静息T细胞中CRISPRa系统的有效传递和功能运行。靶向HIV LTR的CRISPRa-LNP治疗能特异性提升病毒转录中某些阶段的RNA表达,显示高度的靶向性和较低的非特异性激活,虽目前激活程度略低于Tat蛋白mRNA递送,但为开发更安全、更精准的潜伏逆转策略奠定坚实基础。LNP X的高效转染性能不仅体现在病毒相关应用,在靶向激活内源性基因如IL2RA(编码CD25)方面同样表现优异。这意味着LNP X平台具备广泛适用性,有望推动基因调控、细胞免疫治疗及靶向疗法的突破。
荧光报告基因和数字PCR分析技术的结合,使研究人员精确量化了不同整理水平上的病毒基因激活,包括转录起始、延伸、完成及剪接,全面揭示了Tat-LNP X和CRISPRa-LNP X对病毒转录调控的不同影响。值得注意的是,Tat蛋白的单一高效表达虽成功诱导病毒激活和释放,但并未在短期培养内显著减少整合病毒DNA拷贝,这提示潜伏病毒细胞可能具备抗凋亡能力。未来结合释放诱导和免疫清除策略,将是实现病毒库清除的关键方向之一。针对LNP X的作用机制,研究证实其增强转染的主要原因是增强了细胞对纳米颗粒的结合及胞内mRNA翻译效率,而非单纯提升了内体逃逸步骤。β-谷甾醇这一天然胆固醇类似物的引入,避免了传统胆固醇的限制,改进了脂质膜的构象和稳定性,从而优化了mRNA的释放和表达。除此之外,LNP X亦在混合外周血单核细胞中表现出较高的T细胞亲和性,提示其有潜力作为系统性或局部治疗的传递载体。
与传统首代潜伏逆转剂(如组蛋白去乙酰化酶抑制剂)相比,mRNA-LNP技术具备更佳的特异性和安全性。首代药物往往缺乏HIV特异性且存在免疫抑制风险,而LNP X载体可精准传递病毒相关蛋白编码mRNA,实现最小化非靶向效应。未来结合基因编辑技术,如基于CRISPR-Cas9的潜伏病毒切除,或通过敲除病毒入侵受体CCR5等,LNP X平台将推动功能治愈艾滋病的多维度治疗进展。在将研究成果转化为临床应用的过程中,免疫原性评估、体内分布和代谢动力学研究至关重要。历史数据表明mRNA-LNP药物的耐受性良好,剂量范围内安全性可控,但针对静息T细胞的特异靶向化仍是优化方向。利用配体修饰实现LNP靶向T细胞,增强体内积累和生物效应,将极大提升治疗潜力。
此外,采用多剂量联合免疫清除手段,以及个性化设计gRNA序列应对HIV遗传多样性,将进一步提高治疗效果和适用性。当前的研究还存在一些限制,比如对CRISPRa组分的递送效率和半衰期缺乏单独解析,以及潜伏病毒库异质性尚未完全覆盖。但LNP X系统的成功建立为未来多样化、精准化RNA治疗和基因修饰提供了优良平台。总体而言,基于LNP X的mRNA递送技术在逆转HIV潜伏感染中显示极大潜力。它不仅实现了静息T细胞的高效基因传递和病毒激活,还兼顾了细胞安全性和治疗特异性。该策略标志着从传统小分子潜伏逆转剂向新一代基因治疗方案转变的重要里程碑。
未来更多结合细胞免疫疗法、基因编辑和靶向药物递送的多模态治疗策略,将助力实现艾滋病功能性治愈乃至根治。随着技术进步和临床验证的推进,LNP技术推动的mRNA疗法有望为数百万HIV感染者带来福音,开启精准医学时代新纪元。