在艾滋病毒(HIV)研究领域,长期困扰科学家和临床医师的最大障碍之一是病毒潜伏感染的存在。HIV能够在静息的CD4+ T细胞内以潜伏态存在,整合其基因组而不活跃表达病毒蛋白,使病毒逃避免疫系统的监视以及抗逆转录病毒治疗的清除。因而,尽管抗逆转录病毒治疗(ART)能够有效抑制病毒复制,患者却仍需终生服药,且病毒库依然存在有反弹病毒活跃的风险。面对这一难题,研发能够精准、高效激活潜伏病毒,促使感染细胞暴露于免疫系统攻击的新方法,成为实现真正HIV治愈的关键。近期,一种基于脂质纳米颗粒(LNP)技术的mRNA递送平台为转变这一局面带来了前所未有的希望。该技术针对静息CD4+ T细胞,突破了传统基因传递技术的瓶颈,实现高效mRNA递送,进而激活潜伏HIV病毒表达,成为潜伏逆转(latency reversal)策略中的创新突破。
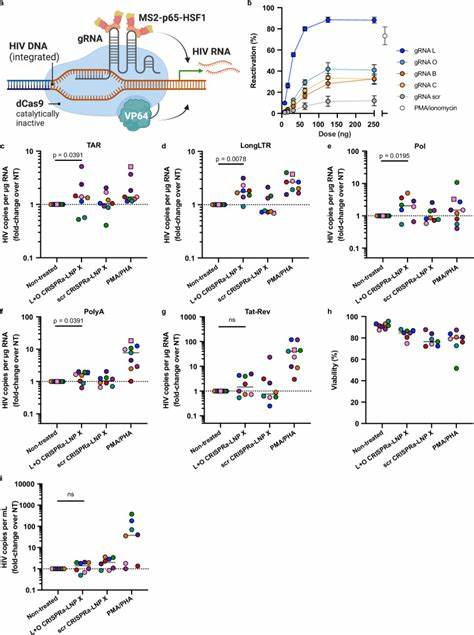
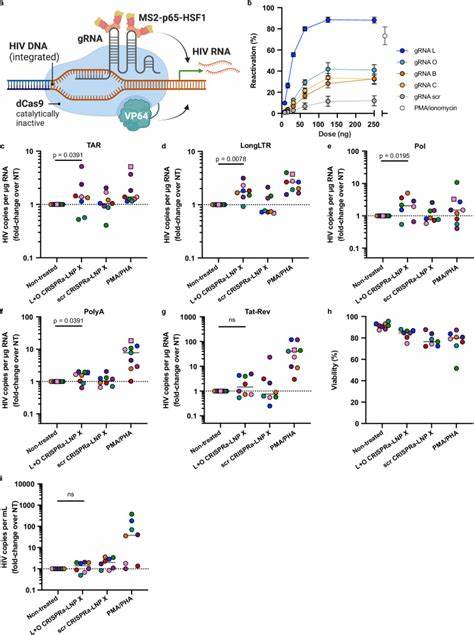
脂质纳米颗粒是一种纳米级的脂质囊泡结构,能够包裹mRNA分子并保护其免受降解,帮助其进入细胞胞内。传统LNP对静息T细胞的递送效率极低,主要受限于细胞的非活化状态和膜结构特性。新一代的LNP配方通过调节脂质组分,如引入SM-102离子化脂质和类植物甾醇β-谷甾醇,显著提升了纳米颗粒与静息T细胞的亲和力与内部化效率。研究团队通过一项称为“LNP X”的独特配方,成功实现了在无须细胞激活条件下,超过75%的静息CD4+ T细胞转染率,并且没有检测到明显的细胞毒性或激活反应。这种高效递送能力,让mRNA在细胞质中得以良好翻译,产生功能完整的蛋白质,从而开启了潜伏病毒的转录。特别值得一提的是,实验中利用编码HIV Tat蛋白的mRNA实现了显著的潜伏期逆转。
Tat蛋白作为HIV转录的强效激活因子,可以直接促进病毒RNA的转录延伸和剪接,克服以往潜伏逆转剂仅启动初期转录而无法完成病毒表达的问题。通过LNP X递送Tat mRNA,CD4+ T细胞内多种病毒转录产物的表达水平得到了强烈提升,涵盖了转录起始、延伸、剪接及完成多个阶段,甚至诱导了病毒颗粒的产生。这种潜伏逆转效果甚至超过了传统T细胞激活剂如PMA和PHA所达到的水平,并且未引起细胞广泛激活,避免了副作用和免疫过激的风险。除此之外,研究还成功将CRISPR激活系统(CRISPRa)共同封装于LNP X中,展示了对指定内源基因及病毒LTR启动子的精准转录激活能力。通过这种基因级调控策略,能够实现针对HIV潜伏基因组的特异性增强,极大地提高潜伏逆转的特异性和安全性。这项技术突破科学界长期以来难以“唤醒”静息T细胞内潜伏病毒的瓶颈问题,为HIV清除策略的设计提供了全新思路。
基于LNP X递送平台的mRNA药物具有可控性强、治疗靶向清晰、免疫激活风险低的优势,在未来临床转化及个性化治疗中具备广阔应用前景。尽管目前的研究主要聚焦体外和离体细胞实验,未来还需开展更多剂量优化、体内分布、免疫原性和长期安全性的评估,推动这一技术从实验室走向临床。结合其他策略,如免疫增强剂、细胞毒性因子或病毒清除手段,与潜伏逆转剂形成协同效应,或将有望实现真正的病毒清除和功能性治愈。此外,LNP X的递送能力不仅局限于HIV潜伏逆转,还可广泛应用于基因治疗、癌症免疫治疗和其他难以传递药物的细胞类型,为生物医药领域带来革命性的转变。综上所述,利用高效脂质纳米颗粒载体递送mRNA至静息CD4+ T细胞,实现了潜伏HIV病毒的有效激活,突破了传统治疗的局限性。这一创举为抗击HIV潜伏库注入了新的活力,标志着mRNA药物在传递技术和功能应用上迈上新台阶。
未来,将基于此平台开发的多样化、特异性的治疗方案,助推HIV治愈目标逐步成为可能,同时也为开发免疫治疗和基因编辑提供了极具价值的技术路径。随着科技的不断进步,mRNA和LNP技术的结合有望开启新的医疗篇章,最终实现深入细胞层面精准治疗,改变包括HIV在内多种疾病的治疗格局。