酒精使用障碍(Alcohol Use Disorder,简称AUD)是一种复杂且多因素驱动的慢性疾病,全球范围内对其的关注与日俱增。虽然已有多种治疗手段,然而面对该疾病的复杂性,现行疗法往往难以全面解决其根源。近年来,随着研究的深入,维生素B1(又称硫胺素)缺乏和神经炎症两大因素日益被认为是理解AUD病理生理和开拓治疗新策略的关键。本文将围绕这两者展开深入解析,阐述其在酒精使用障碍中的作用机制及未来研究方向。 维生素B1的重要性体现在其作为多种关键代谢酶的辅酶,参与细胞能量代谢和抗氧化功能。硫胺素的活性形式硫胺素焦磷酸(TPP)是丙酮酸脱氢酶、α-酮戊二酸脱氢酶和转酮醇酶等关键酶的必需辅因子。
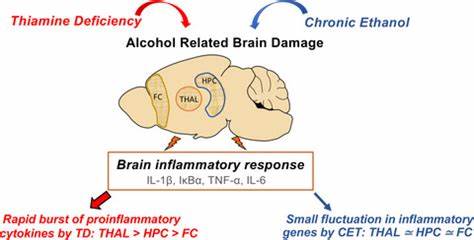
这些酶在三羧酸循环及磷酸戊糖途径中担负重要角色,直接关系到细胞ATP的生成及抗氧化物质NADPH的供应。过度饮酒不仅加剧维生素B1的摄入不足,还通过抑制肠道吸收和酶活化,导致维生素B1缺乏。 此类缺乏在酒精使用者中极为常见,相关研究表明多达80%的AUD患者存在维生素B1缺乏现象。缺乏维生素B1直接导致辅酶参与的代谢路径受阻,如丙酮酸无法有效转化为乙酰辅酶A,能量代谢陷入停滞,脑部尤其易受影响,表现为代谢缺陷、氧化应激增加以及神经细胞死亡。临床上表现则包括认知障碍、记忆力减退,甚至严重的维生素B1缺乏性脑病,即韦尼克-科尔萨科夫综合征。 维生素B1缺乏同样会影响细胞内的氧化还原状态。
转酮醇酶活性的下降导致磷酸戊糖途径中NADPH生成减少,进而削弱谷胱甘肽和硫氧还蛋白等抗氧化系统的功能,造成氧化应激状态。氧化应激不仅损害细胞膜及DNA,还促进促炎因子的释放,激活了神经免疫系统。此时,参与免疫监视的微胶质细胞被激活,产生大量的炎症介质,诱发或加剧神经炎症。 说到神经炎症,酒精摄入通过激活多种免疫受体,尤其是模式识别受体TLR4(Toll样受体4)和NLRP3炎症小体在该过程中扮演中心角色。酒精破坏肠道屏障,使细菌内毒素如脂多糖(LPS)进入血液循环,刺激肝脏和中枢神经系统的免疫细胞。LPS及酒精诱导释放的“危险信号”蛋白HMGB1可激活TLR4,进一步诱导核因子NF-κB活化,导致多种促炎细胞因子生成。
TLR4信号通路对酒精相关的神经炎症、白质损伤以及认知功能减退具有明显贡献。 NLRP3炎症小体则在认识酒精诱导的炎症反应中崭露头角。其活化涉及先通过TLR4信号完成基因表达的“启动”,继而依赖ROS等细胞应激因子触发炎症复合物组装,激活半胱天冬酶-1,促使促炎性细胞因子IL-1β和IL-18成熟分泌,甚至引发细胞焦亡。酒精持续刺激增强了NLRP3的活性,诱导神经细胞损伤和慢性炎症状态,并且与酒精摄入量和相关行为密切相关。 当前研究揭示,维生素B1缺乏不仅仅是代谢紊乱的结果,更直接参与神经炎症的放大过程。实验动物模型显示,维生素B1缺乏状态下,微胶质细胞和星形胶质细胞的激活程度显著上升,促炎细胞因子表达增加,脑内血脑屏障渗透性受损。
这些病理变化与酒精引发的炎症相互叠加,共同加剧神经损伤。同时,维生素B1缺乏对神经递质系统也产生影响,例如增强GABA合成及调节谷氨酸代谢,这些变化均与酒精依赖中的奖励机制和神经可塑性有关。 在探究治疗的可能性方面,硫胺素补充常被用于预防和治疗酒精性脑病,尤其在急性韦尼克脑病患者中发挥明显效益。然而,硫胺素的广泛应用仍受限制,亟需进一步推动其临床普及。除此之外,小分子药物如TLR4拮抗剂TAK-242和NLRP3抑制剂MCC950展现出减轻神经炎症以及调节酒精摄入行为的潜力。另一类含有抗氧化及抗炎性的营养补充剂 — 硫胺素衍生物本福硫胺素(benfotiamine),也因其较高的生物利用度及多重保护作用备受关注,并显示能够降低酒精摄入。
未来的研究应注重从整体病理生理角度出发,深入剖析维生素B1缺乏与神经炎症之间的交互机制,探求更具针对性与综合性的治疗策略。探索新的治疗靶点如TREM2通路、调节免疫代谢的机制等,为酒精使用障碍提供更有效、持久的治疗方案具备巨大前景。 总而言之,酒精使用障碍的发生发展与维生素B1缺乏和神经炎症这两大因素紧密相关。它们分别通过代谢紊乱与免疫激活,共同塑造了疾病的复杂生物学背景。推进相关机制的研究不仅丰富了我们对AUD的理解,也为未来治疗提供了新方向,期待通过药物与营养干预,改善患者预后,减缓社会经济负担。