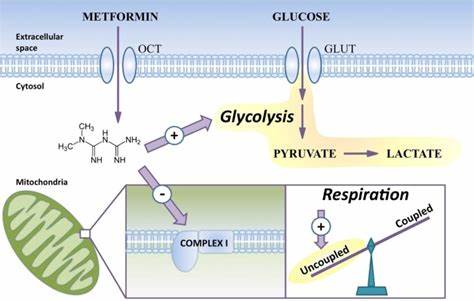
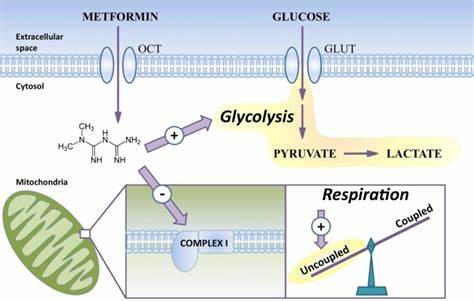
二甲双胍作为一种广泛应用于2型糖尿病治疗的药物,近年来因其在多种细胞功能调节中的多重作用而备受关注。特别是在神经科学领域,研究者们发现二甲双胍能够影响细胞的线粒体代谢,从而促进神经系统相关细胞的功能恢复和再生。寡突胶质细胞是中枢神经系统中的关键神经胶质细胞,主要职责是形成并维护髓鞘,支持神经元的电信号传导及代谢需求。随着年龄增长和疾病进展,寡突胶质细胞的功能减退与髓鞘损伤密切相关,如多发性硬化症(MS)患者中的神经损伤便源于髓鞘的丢失和修复功能的不足。最新的研究表明,二甲双胍具有促进寡突胶质细胞功能和增强髓鞘生成的潜力,为神经退行性疾病的治疗提供了新视角。二甲双胍作用的核心机制之一是其对线粒体电子传递链第一复合体(Complex I)的抑制,这一作用导致细胞内AMP:ATP比率变化,激活AMP活化蛋白激酶(AMPK)信号通路,进而调节细胞的能量代谢。
通过激活AMPK,二甲双胍能够促进代谢状态的重塑,提升细胞对能量需求的响应能力。随着线粒体功能的改善,细胞内ATP供应增强,为细胞的分化和修复活动提供必要能量。特别是在衰老或病变背景下,寡突胶质前体细胞(OPCs)对促分化信号的响应能力降低,导致髓鞘再生能力减弱。二甲双胍通过调节线粒体功能逆转了这一过程,促进OPCs分化为成熟的髓鞘形成细胞,提高了髓鞘修复效率。体外实验进一步证实,二甲双胍能够显著增加从人类胚胎干细胞诱导的寡突胶质细胞的成熟指标,如髓磷脂碱性蛋白(MBP)的表达以及髓鞘形成数量。在单层培养体系中,未经处理的细胞往往表现出更为幼稚的胎儿样表型,二甲双胍可推动这些细胞的向成熟细胞转化,显示出明显的分化促进作用。
此外,三维脑类器官模型提供了更为复杂的细胞微环境,让细胞能够与不同类型的神经细胞进行交互。在该模型中,二甲双胍不仅提升了寡突胶质细胞成熟,还显著扩大了MBP阳性区域,显示其在促使髓鞘形成方面的积极影响。这些证据均提示,二甲双胍在更接近体内的复杂环境中依旧保有促进寡突胶质细胞功能的能力。更为重要的是,将人类来源的寡突胶质前体细胞移植至免疫缺陷型小鼠大脑中建立的嵌合体模型揭示,二甲双胍治疗能显著增加髓鞘形成的范围及质量。显微镜下观察显示,经二甲双胍治疗的动物中,人源寡突胶质细胞形成的髓鞘包裹的轴突比例明显上升,髓鞘厚度亦有所增加,表明其不仅支持细胞分化,更促进成熟髓鞘功能的恢复。超微结构分析揭示,二甲双胍处理组中不仅寡突胶质细胞线粒体数量或体积增加,轴突内的线粒体形态及数量也有所改善。
这表明二甲双胍对神经胶质细胞及周围神经元的线粒体代谢均产生相互作用,有助于整体轴突髓鞘系统的能量支持。基因表达层面,二甲双胍提升了多种与线粒体功能相关的核编码基因,如NDUFA11和COX8A,这两者分别隶属于线粒体电子传递链的复合体I和复合体IV,保证了呼吸链的高效运转与ATP生成。同时,EIF1的表达上升有助于促进线粒体相关蛋白翻译的有效启动,强化细胞能量供应链的稳定。上述基因调控均体现了二甲双胍通过改善线粒体功能,间接促进了寡突胶质细胞代谢状态的优化,创造了有利于髓鞘生成的细胞环境。值得强调的是,这种代谢调节并非局限于人源寡突胶质细胞,动物宿主的神经细胞和胶质细胞亦出现了类似的基因表达变化,提示二甲双胍具有广泛的脑内代谢调节能力。回顾临床样本中,多发性硬化症患者若在病前或病中接受二甲双胍治疗,其脑内寡突胶质细胞同样表现出EIF1等代谢基因的上调,间接反映了二甲双胍在人类脑组织内的活性和潜在疗效。
虽然相关临床研究仍处于初级阶段,但已有多项试验正在评估二甲双胍作为神经保护剂在多发性硬化症等神经退行性疾病的疗效,其安全性和有效性令人期待。二甲双胍的功效不仅仅停留在其经典的降血糖作用,作为一种线粒体复合体I抑制剂,其对神经系统的多层面调控具有深远意义。通过调整能源代谢与细胞能量转换效率,二甲双胍为衰老或病理状态下的寡突胶质细胞和神经元提供了修复和再生的代谢支持。未来,基于二甲双胍的剂量和给药窗优化,结合多平台细胞模型和动物模型,我们有望更准确地揭示其作用机制和临床应用价值。同时,深入探究二甲双胍与其他促髓鞘生成药物的联合应用,也可能为神经疾病的综合治疗带来创新思路。总结来说,二甲双胍通过抑制线粒体复合体I活性,启动代谢及细胞能量调节信号通路,促进人类寡突胶质细胞的成熟与髓鞘形成,展现出极大潜力用于神经退行性疾病的治疗。
其对线粒体形态及功能的积极调节,连同对髓鞘蛋白质产量和神经元功能的促进,使二甲双胍成为该领域备受瞩目的候选药物。随着未来研究的深入,二甲双胍有望成为对抗中枢神经系统疾病损伤、促进神经再生的关键药物之一,为患者带来实质性的治疗改善。 。